Quest for the right Drug
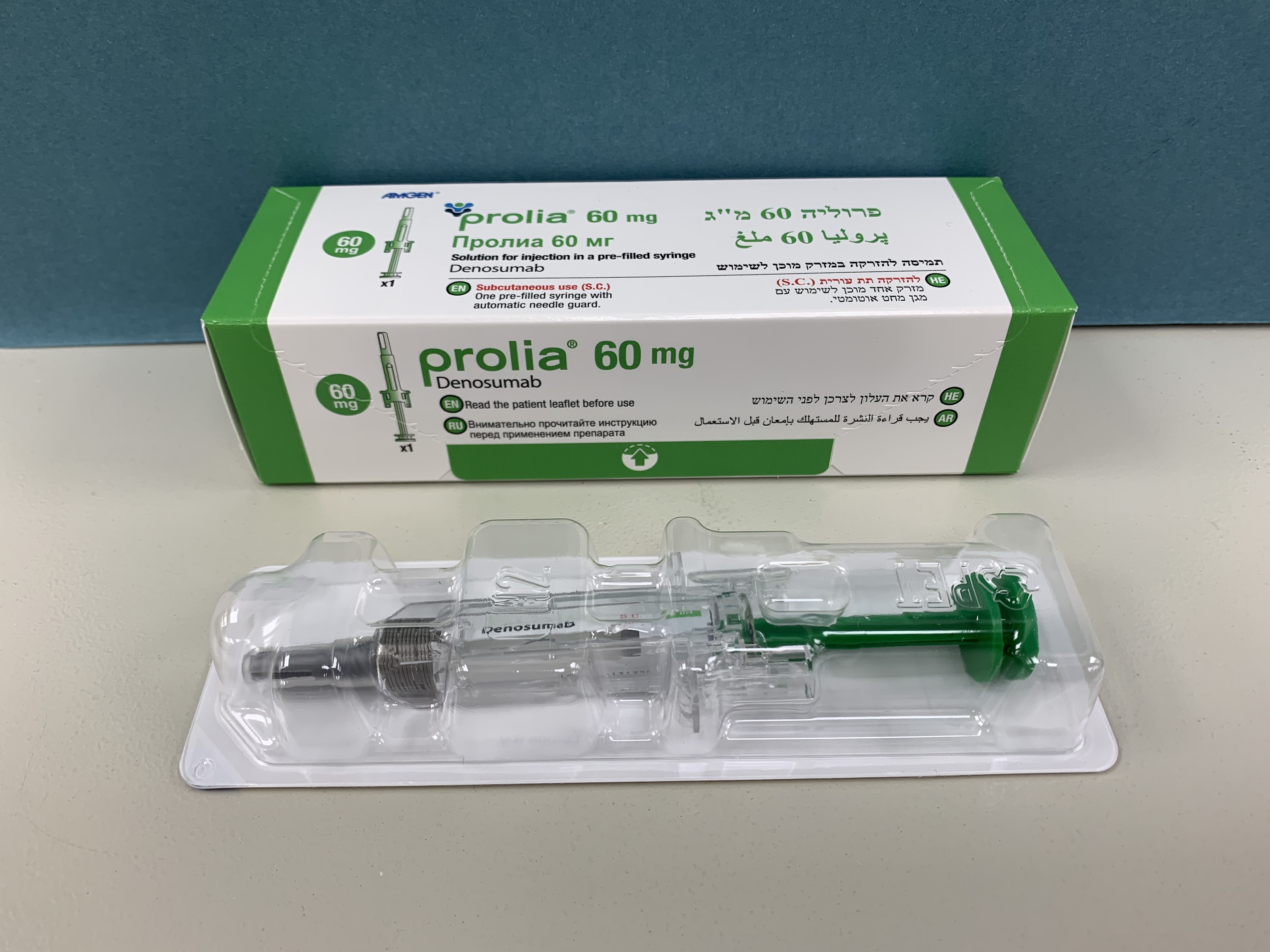
פרוליה 60 מ"ג PROLIA 60 MG (DENOSUMAB)
תרופה במרשם
תרופה בסל
נרקוטיקה
ציטוטוקסיקה
צורת מתן:
תת-עורי : S.C
צורת מינון:
תמיסה להזרקה : SOLUTION FOR INJECTION
עלון לרופא
מינוניםPosology התוויות
Indications תופעות לוואי
Adverse reactions התוויות נגד
Contraindications אינטראקציות
Interactions מינון יתר
Overdose הריון/הנקה
Pregnancy & Lactation אוכלוסיות מיוחדות
Special populations תכונות פרמקולוגיות
Pharmacological properties מידע רוקחי
Pharmaceutical particulars אזהרת שימוש
Special Warning עלון לרופא
Physicians Leaflet
Posology : מינונים
4.2 Posology and method of administration Posology The recommended dose is 60 mg denosumab administered as a single subcutaneous injection once every 6 months into the thigh, abdomen or upper arm. Patients must be adequately supplemented with calcium and vitamin D (see section 4.4). Patients treated with Prolia should be given the package leaflet and the patient safety information card. The optimal total duration of antiresorptive treatment for osteoporosis (including both denosumab and bisphosphonates) has not been established. The need for continued treatment should be re-evaluated periodically based on the benefits and potential risks of denosumab on an individual patient basis, particularly after 5 or more years of use (see section 4.4). Elderly (age ≥ 65) No dose adjustment is required in elderly patients. Renal impairment No dose adjustment is required in patients with renal impairment (see section 4.4 for recommendations relating to monitoring of calcium). No data is available in patients with long-term systemic glucocorticoid therapy and severe renal impairment (GFR < 30 mL/min). Hepatic impairment The safety and efficacy of denosumab have not been studied in patients with hepatic impairment (see section 5.2). Pediatric population Prolia is not indicated for use in children and adolescents below 18 years. Method of administration For subcutaneous use. Administration should be performed by an individual who has been adequately trained in injection techniques. The instructions for use, handling and disposal are given in section 6.6.

פרטי מסגרת הכללה בסל
א. התרופה האמורה תינתן לטיפול במקרים האלה:1. חולות אוסטיאופורוזיס פוסט מנופאוזליות הזכאיות לטיפול על פי הקריטריונים הקיימים בסל לטיפול בביספוספונאטים או Raloxifene לאחר מיצוי הטיפולים הפומיים הקיימים בסל או החמרה מובהקת של אוסטיאופורוזיס בטיפול קבוע בביספוספונאטים או רלוקסיפן בשנתיים האחרונות;2. גברים החולים באוסטיאופורוזיס הזכאים לטיפול על פי הקריטריונים הקיימים בסל לטיפול בביספוספונאטים לאחר מיצוי הטיפולים הפומיים הקיימים בסל או החמרה מובהקת של אוסטיאופורוזיס בטיפול קבוע בביספוספונאטים בשנתיים האחרונות;3. אוסטיאופורוזיס בנשים פוסט מנופאוזליות ובגברים לאחר שבר בצוואר הירך. ב. אם קיבל החולה טיפול ב-Zoledronic acid – לא יקבל טיפול ב-Densoumab או Strontium Ranelate 12 חודשים מהמנה האחרונה; אם קיבל החולה טיפול ב-Densoumab – לא יקבל טיפול ב-Zoledronic acid או Strontium Ranelate 6 חודשים מהמנה האחרונה.
מסגרת הכללה בסל
התוויות הכלולות במסגרת הסל
| התוויה | תאריך הכללה | תחום קליני | Class Effect | מצב מחלה |
|---|---|---|---|---|
| אוסטיאופורוזיס בנשים פוסט מנופאוזליות ובגברים לאחר שבר בצוואר הירך. | ||||
| גברים החולים באוסטיאופורוזיס | ||||
| חולות אוסטיאופורוזיס פוסט מנופאוזליות | ||||
| גרורות בעצמות מגידולים סולידיים עבור חולים הסובלים מפגיעה בתפקוד הכלייתי שמונעת מהם לקבל טיפול ב-Zoledronic acid; | ||||
| גרורות בעצמות בחולי סרטן ערמונית גרורתי |
שימוש לפי פנקס קופ''ח כללית 1994
לא צוין
תאריך הכללה מקורי בסל
10/01/2012
הגבלות
תרופה מוגבלת לרישום ע'י רופא מומחה או הגבלה אחרת
מידע נוסף
עלון מידע לצרכן
27.05.13 - עלון לצרכן 08.08.13 - עלון לצרכן 01.09.14 - עלון לצרכן 24.08.15 - עלון לצרכן 27.03.17 - עלון לצרכן 02.12.20 - עלון לצרכן אנגלית 31.05.22 - עלון לצרכן אנגלית 31.05.22 - עלון לצרכן עברית 28.10.20 - עלון לצרכן ערבית 31.05.22 - עלון לצרכן ערבית 13.02.24 - עלון לצרכן אנגלית 13.02.24 - עלון לצרכן עברית 04.03.24 - עלון לצרכן ערבית 12.08.12 - החמרה לעלון 20.09.18 - החמרה לעלון 10.10.18 - החמרה לעלון 16.05.19 - החמרה לעלון 24.10.19 - החמרה לעלון 21.09.20 - החמרה לעלון 28.10.20 - החמרה לעלון 02.12.20 - החמרה לעלון 12.01.21 - החמרה לעלון 17.04.22 - החמרה לעלון 12.05.22 - החמרה לעלון 22.05.22 - החמרה לעלון 01.08.21 - החמרה לעלוןלתרופה במאגר משרד הבריאות
פרוליה 60 מ"ג