Quest for the right Drug
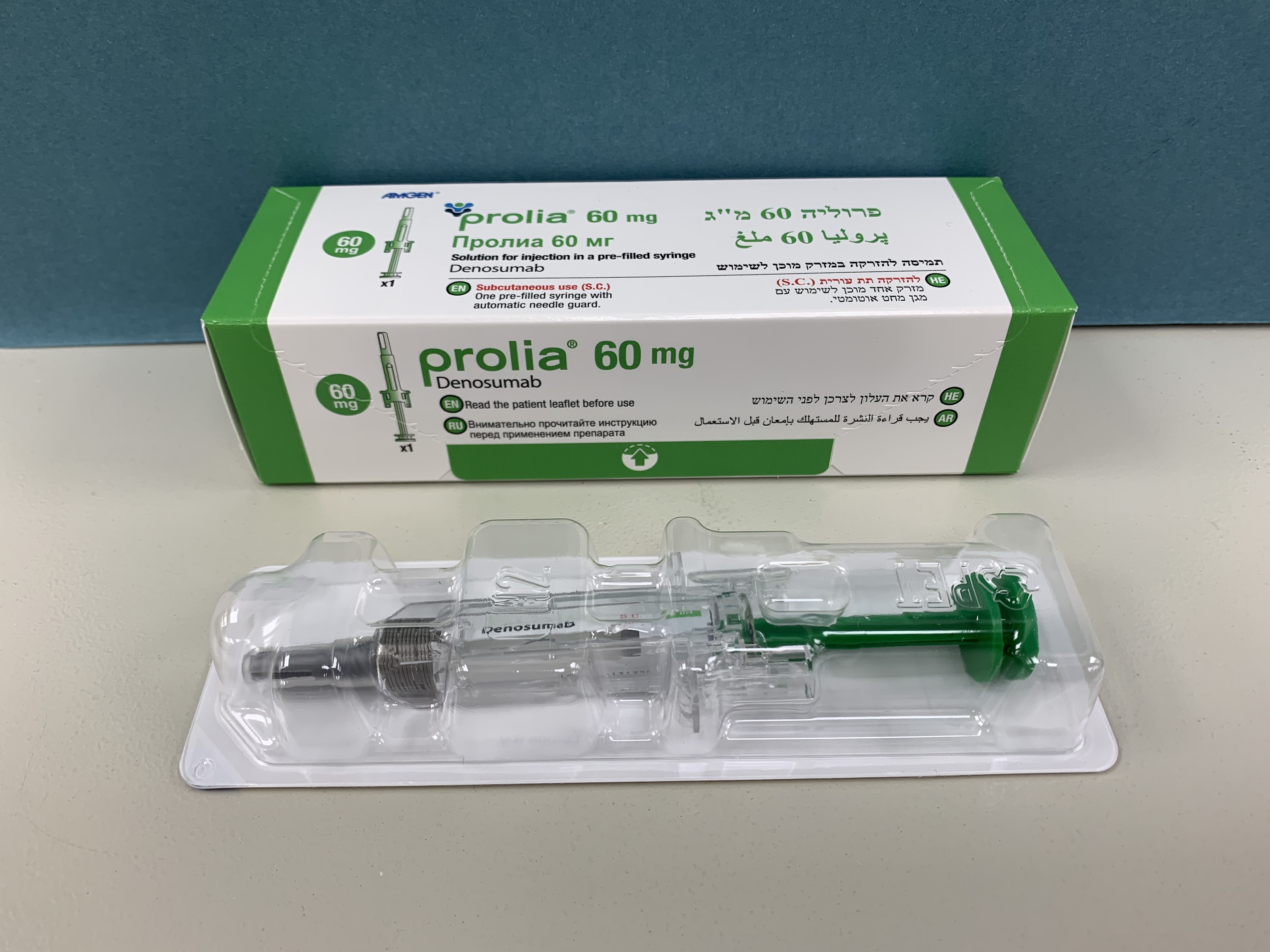
פרוליה 60 מ"ג PROLIA 60 MG (DENOSUMAB)
תרופה במרשם
תרופה בסל
נרקוטיקה
ציטוטוקסיקה
צורת מתן:
תת-עורי : S.C
צורת מינון:
תמיסה להזרקה : SOLUTION FOR INJECTION
עלון לרופא
מינוניםPosology התוויות
Indications תופעות לוואי
Adverse reactions התוויות נגד
Contraindications אינטראקציות
Interactions מינון יתר
Overdose הריון/הנקה
Pregnancy & Lactation אוכלוסיות מיוחדות
Special populations תכונות פרמקולוגיות
Pharmacological properties מידע רוקחי
Pharmaceutical particulars אזהרת שימוש
Special Warning עלון לרופא
Physicians Leaflet
Pregnancy & Lactation : הריון/הנקה
4.6 Fertility, pregnancy and lactation Pregnancy There are no or limited amount of data from the use of denosumab in pregnant women. Studies in animals have shown reproductive toxicity (see section 5.3). Prolia is not recommended for use in pregnant women and women of child-bearing potential not using contraception. Women should be advised not to become pregnant during and for at least 5 months after treatment with Prolia. Any effects of Prolia are likely to be greater during the second and third trimesters of pregnancy since monoclonal antibodies are transported across the placenta in a linear fashion as pregnancy progresses, with the largest amount transferred during the third trimester. Breast-feeding It is unknown whether denosumab is excreted in human milk. In genetically engineered mice in which RANKL has been turned off by gene removal (a “knockout mouse”), studies suggest absence of RANKL (the target of denosumab, see section 5.1) during pregnancy may interfere with maturation of the mammary gland leading to impaired lactation post-partum (see section 5.3). A decision on whether to abstain from breast-feeding or to abstain from therapy with Prolia should be made, taking into account the benefit of breast-feeding to the newborn/infant and the benefit of Prolia therapy to the woman. Fertility No data are available on the effect of denosumab on human fertility. Animal studies do not indicate direct or indirect harmful effects with respect to fertility (see section 5.3).

פרטי מסגרת הכללה בסל
א. התרופה האמורה תינתן לטיפול במקרים האלה:1. חולות אוסטיאופורוזיס פוסט מנופאוזליות הזכאיות לטיפול על פי הקריטריונים הקיימים בסל לטיפול בביספוספונאטים או Raloxifene לאחר מיצוי הטיפולים הפומיים הקיימים בסל או החמרה מובהקת של אוסטיאופורוזיס בטיפול קבוע בביספוספונאטים או רלוקסיפן בשנתיים האחרונות;2. גברים החולים באוסטיאופורוזיס הזכאים לטיפול על פי הקריטריונים הקיימים בסל לטיפול בביספוספונאטים לאחר מיצוי הטיפולים הפומיים הקיימים בסל או החמרה מובהקת של אוסטיאופורוזיס בטיפול קבוע בביספוספונאטים בשנתיים האחרונות;3. אוסטיאופורוזיס בנשים פוסט מנופאוזליות ובגברים לאחר שבר בצוואר הירך. ב. אם קיבל החולה טיפול ב-Zoledronic acid – לא יקבל טיפול ב-Densoumab או Strontium Ranelate 12 חודשים מהמנה האחרונה; אם קיבל החולה טיפול ב-Densoumab – לא יקבל טיפול ב-Zoledronic acid או Strontium Ranelate 6 חודשים מהמנה האחרונה.
מסגרת הכללה בסל
התוויות הכלולות במסגרת הסל
| התוויה | תאריך הכללה | תחום קליני | Class Effect | מצב מחלה |
|---|---|---|---|---|
| אוסטיאופורוזיס בנשים פוסט מנופאוזליות ובגברים לאחר שבר בצוואר הירך. | ||||
| גברים החולים באוסטיאופורוזיס | ||||
| חולות אוסטיאופורוזיס פוסט מנופאוזליות | ||||
| גרורות בעצמות מגידולים סולידיים עבור חולים הסובלים מפגיעה בתפקוד הכלייתי שמונעת מהם לקבל טיפול ב-Zoledronic acid; | ||||
| גרורות בעצמות בחולי סרטן ערמונית גרורתי |
שימוש לפי פנקס קופ''ח כללית 1994
לא צוין
תאריך הכללה מקורי בסל
10/01/2012
הגבלות
תרופה מוגבלת לרישום ע'י רופא מומחה או הגבלה אחרת
מידע נוסף
עלון מידע לצרכן
27.05.13 - עלון לצרכן 08.08.13 - עלון לצרכן 01.09.14 - עלון לצרכן 24.08.15 - עלון לצרכן 27.03.17 - עלון לצרכן 02.12.20 - עלון לצרכן אנגלית 31.05.22 - עלון לצרכן אנגלית 31.05.22 - עלון לצרכן עברית 28.10.20 - עלון לצרכן ערבית 31.05.22 - עלון לצרכן ערבית 13.02.24 - עלון לצרכן אנגלית 13.02.24 - עלון לצרכן עברית 04.03.24 - עלון לצרכן ערבית 12.08.12 - החמרה לעלון 20.09.18 - החמרה לעלון 10.10.18 - החמרה לעלון 16.05.19 - החמרה לעלון 24.10.19 - החמרה לעלון 21.09.20 - החמרה לעלון 28.10.20 - החמרה לעלון 02.12.20 - החמרה לעלון 12.01.21 - החמרה לעלון 17.04.22 - החמרה לעלון 12.05.22 - החמרה לעלון 22.05.22 - החמרה לעלון 01.08.21 - החמרה לעלוןלתרופה במאגר משרד הבריאות
פרוליה 60 מ"ג