Quest for the right Drug
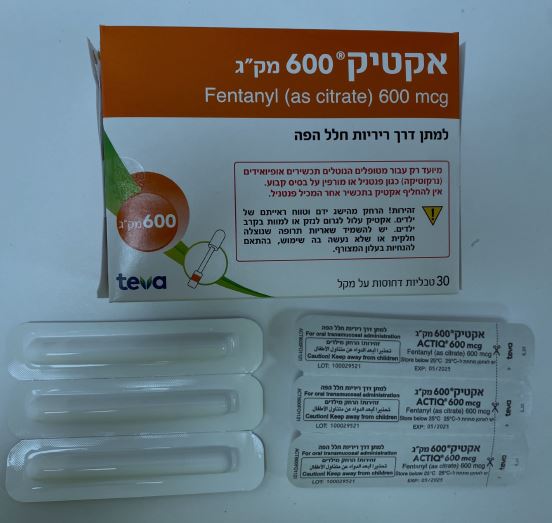
אקטיק 600 מק"ג ACTIQ 600 MCG (FENTANYL AS CITRATE)
תרופה במרשם
תרופה בסל
נרקוטיקה
ציטוטוקסיקה
צורת מתן:
פומי בחלל הפה : ORAL TRANSMUCOSAL
צורת מינון:
טבליות דחוסות על מקל : COMPRESSED TABLET ON A HANDLE
עלון לרופא
מינוניםPosology התוויות
Indications תופעות לוואי
Adverse reactions התוויות נגד
Contraindications אינטראקציות
Interactions מינון יתר
Overdose הריון/הנקה
Pregnancy & Lactation אוכלוסיות מיוחדות
Special populations תכונות פרמקולוגיות
Pharmacological properties מידע רוקחי
Pharmaceutical particulars אזהרת שימוש
Special Warning עלון לרופא
Physicians Leaflet
Adverse reactions : תופעות לוואי
4.8 Undesirable effects Typical opioid adverse reactions are to be expected with ACTIQ. Frequently, these will cease or decrease in intensity with continued use of the product, as the patient is titrated to the most appropriate dose. However, the most serious adverse events are respiratory depression (potentially leading to apnoea or respiratory arrest), circulatory depression, hypotension and shock and all patients should be closely monitored for these. Application site reactions, including gum bleeding, irritation, pain and ulcer have been reported in post-marketing use. Because the clinical trials of ACTIQ were designed to evaluate safety and efficacy in treating breakthrough pain, all patients were also taking concomitant opioids, such as sustained-release morphine or transdermal fentanyl, for their persistent pain. Thus it is not possible to definitively separate the effects of ACTIQ alone. The following adverse reactions have been reported with ACTIQ and/or other fentanyl-containing compounds during clinical studies and post marketing experience. Adverse reactions are listed below as MedDRA preferred term by system organ class and frequency (frequencies are defined as: very common ≥1/10, common ≥1/100 to <1/10, uncommon ≥ 1/1,000 to <1/100, not known (cannot be estimated from the available data): System organ Very common common uncommon Not known class Immune system anaphylactic disorders reaction, tongue oedema, lip oedema Endocrine adrenal disorders insufficiency, androgen deficiency Metabolism and anorexia nutrition disorders Psychiatric confusion, abnormal dreams, Insomnia, drug disorders anxiety, depersonalisation, dependence hallucinations, abnormal (addiction), depression, thinking, drug abuse (see emotional lability euphoria section 4.4), delirium Nervous system somnolence, loss of consciousness, coma, disorders dizziness, convulsion, slurred speech headache vertigo, myoclonus, sedation, paraesthesia (including hyperaesthesia/circumor al paraesthesia), abnormal gait/incoordination, taste perversion Eye disorders abnormal vision (blurred, double vision) Vascular vasodilatation flushing, disorders hot flush Respiratory, dyspnoea pharyngeal thoracic and oedema, mediastinal respiratory disorders depression, sleep apnoea syndrome Gastrointestinal nausea, dry mouth, ileus, tooth loss, disorders vomiting, dyspepsia, mouth ulcers, gingival constipation, stomatitis, dental caries, recession, abdominal tongue disorder (for gingival bleeding gingivitis, pain example, burning diarrhoea sensation, ulcers), flatulence, abdomen enlarged Skin and pruritus, urticaria subcutaneous sweating, tissue disorders rash Renal and urinary retention urinary disorders General asthenia application site reactions fatigue, System organ Very common common uncommon Not known class disorders and including irritation, pain peripheral administration and ulcer, oedema, site conditions malaise pyrexia, withdrawal syndrome*, neonatal withdrawal syndrome (see section 4.6), drug tolerance, bleeding at the site of application Investigations weight decreased Injury, accidental injury (for poisoning and example, falls) procedural complications * opioid withdrawal symptoms such as nausea, vomiting, diarrhoea, anxiety, chills, tremor, and sweating have been observed with transmucosal fentanyl. Description of selected adverse reactions Tolerance Tolerance can develop on repeated use. Drug dependence Repeated use of ACTIQ leads to drug dependence, even at therapeutic doses. The risk of drug dependence may vary depending on a patient's individual risk factors, dosage, and duration of opioid treatment (see section 4.4). Reporting of suspected adverse reactions Reporting suspected adverse reactions after authorisation of the medicinal product is important. It allows continued monitoring of the benefit/risk balance of the medicinal product. Any suspected adverse events should be reported to the Ministry of Health according to the National Regulation by using an online form https://sideeffects.health.gov.il/

פרטי מסגרת הכללה בסל
התרופה תינתן לטיפול בכאב מתפרץ בחולי סרטן. התחלת הטיפול בתרופה יעשה על פי מרשם של רופא מומחה באונקולוגיה, או בהמטואונקולוגיה או בכאב או בנוירולוגיה או בהרדמה
מסגרת הכללה בסל
התוויות הכלולות במסגרת הסל
| התוויה | תאריך הכללה | תחום קליני | Class Effect | מצב מחלה |
|---|---|---|---|---|
| לטיפול בכאב מתפרץ בחולי סרטן | 01/03/2008 |
שימוש לפי פנקס קופ''ח כללית 1994
לא צוין
תאריך הכללה מקורי בסל
01/03/2008
הגבלות
תרופה מוגבלת לרישום ע'י רופא מומחה או הגבלה אחרת
מידע נוסף
עלון מידע לצרכן
14.07.21 - עלון לצרכן אנגלית 23.02.22 - עלון לצרכן אנגלית 14.07.21 - עלון לצרכן עברית 15.08.22 - עלון לצרכן עברית 14.07.21 - עלון לצרכן ערבית 23.02.22 - עלון לצרכן ערבית 12.10.22 - עלון לצרכן ערבית 14.11.22 - עלון לצרכן אנגלית 14.11.22 - עלון לצרכן עברית 14.11.22 - עלון לצרכן ערבית 15.08.23 - עלון לצרכן אנגלית 15.08.23 - עלון לצרכן 15.08.23 - עלון לצרכן אנגלית 21.08.23 - עלון לצרכן אנגלית 21.08.23 - עלון לצרכן עברית 21.08.23 - עלון לצרכן ערבית 21.06.24 - עלון לצרכן אנגלית 21.06.24 - עלון לצרכן עברית 21.06.24 - עלון לצרכן ערבית 17.01.19 - החמרה לעלון 22.10.19 - החמרה לעלון 06.07.20 - החמרה לעלון 10.01.21 - החמרה לעלון 14.07.21 - החמרה לעלון 20.10.21 - החמרה לעלון 03.01.22 - החמרה לעלון 15.08.22 - החמרה לעלון 12.10.22 - החמרה לעלון 15.06.24 - החמרה לעלוןלתרופה במאגר משרד הבריאות
אקטיק 600 מק"ג