Quest for the right Drug
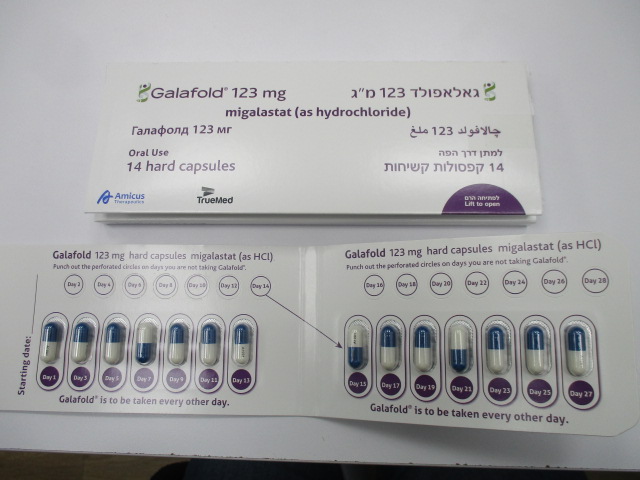
גאלאפולד 123 מ"ג GALAFOLD 123 MG (MIGALASTAT AS HYDROCHLORIDE)
תרופה במרשם
תרופה בסל
נרקוטיקה
ציטוטוקסיקה
צורת מתן:
פומי : PER OS
צורת מינון:
קפסולה קשיחה : CAPSULE, HARD
עלון לרופא
מינוניםPosology התוויות
Indications תופעות לוואי
Adverse reactions התוויות נגד
Contraindications אינטראקציות
Interactions מינון יתר
Overdose הריון/הנקה
Pregnancy & Lactation אוכלוסיות מיוחדות
Special populations תכונות פרמקולוגיות
Pharmacological properties מידע רוקחי
Pharmaceutical particulars אזהרת שימוש
Special Warning עלון לרופא
Physicians Leaflet
Adverse reactions : תופעות לוואי
4.8 Undesirable effects Summary of the safety profile The most common adverse reaction was headache, which was experienced by approximately 10% of patients who received Galafold 123mg. Tabulated list of adverse reactions Frequencies are defined as: very common (≥1/10), common (≥1/100 to <1/10), uncommon (≥1/1,000 to <1/100), rare (≥1/10,000 to <1/1,000), very rare (<1/10,000) and not known (cannot be estimated from the available data). Within each frequency grouping, adverse reactions are presented in order of decreasing frequency within each System Organ Class. Table 1: Adverse reactions with Galafold System organ class Very common Common Psychiatric disorders Depression Nervous system disorders Headache Paraesthesia Dizziness Hypoaesthesia Ear and labyrinth disorders Vertigo Cardiac disorders Palpitations Respiratory, thoracic, and Dyspnoea mediastinal disorders Epistaxis Gastrointestinal disorders Diarrhoea Nausea Abdominal pain Constipation Dry mouth Defaecation urgency Dyspepsia Skin and subcutaneous tissue Rash disorders Pruritus Musculoskeletal and Muscle spasms connective tissue disorders Myalgia Torticollis Pain in extremity Renal and urinary disorders Proteinuria General disorders and Fatigue administration site conditions Pain Investigations Blood creatine phosphokinase increased Weight increased Adolescent population The safety assessment in 21 adolescents (12 to < 18 years of age and weighing ≥ 45 kg) is based on 1-year safety data from the open label AT1001-020 trial in which subjects received the same dosage regimen as adults (see section 5.2). No age-specific differences in adverse reactions were observed between adolescent and adult subjects. The frequency, type and severity of adverse reactions in adolescents are expected to be the same as in adults based on these data. Reporting of suspected adverse reactions Reporting suspected adverse reactions after authorization of the medicinal product is important. It allows continued monitoring of the benefit/risk balance of the medicinal product. Any suspected adverse events should be reported to the Ministry of Health according to the National Regulation by using an online form https://sideeffects.health.gov.il/

פרטי מסגרת הכללה בסל
א. התרופה תינתן לטיפול במחלת פברי בחולה עם מוטציה מגיבה העונה על אחד מאלה:1. החמרת סימפטומים למרות טיפול אנזימטי חלופי (ERT ).2. אי סבילות לטיפול אנזימטי חלופי (ERT).ב. התרופה לא תינתן בשילוב עם טיפול אנזימטי חלופי (ERT) למחלה זו.
שימוש לפי פנקס קופ''ח כללית 1994
לא צוין
תאריך הכללה מקורי בסל
11/01/2018
הגבלות
תרופה מוגבלת לרישום ע'י רופא מומחה או הגבלה אחרת
ATC
מידע נוסף
