Quest for the right Drug
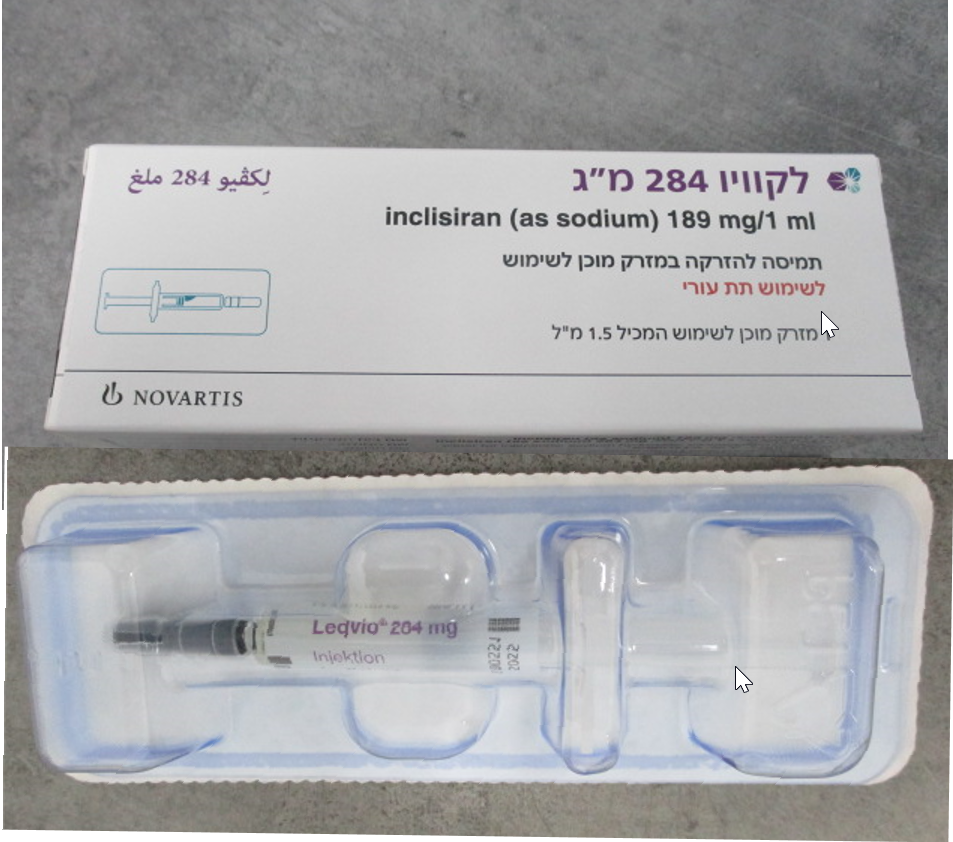
לקוויו 284מ"ג LEQVIO 284 MG (INCLISIRAN AS SODIUM)
תרופה במרשם
תרופה בסל
נרקוטיקה
ציטוטוקסיקה
צורת מתן:
תת-עורי : S.C
צורת מינון:
תמיסה להזרקה : SOLUTION FOR INJECTION
עלון לרופא
מינוניםPosology התוויות
Indications תופעות לוואי
Adverse reactions התוויות נגד
Contraindications אינטראקציות
Interactions מינון יתר
Overdose הריון/הנקה
Pregnancy & Lactation אוכלוסיות מיוחדות
Special populations תכונות פרמקולוגיות
Pharmacological properties מידע רוקחי
Pharmaceutical particulars אזהרת שימוש
Special Warning עלון לרופא
Physicians Leaflet
Pharmaceutical particulars : מידע רוקחי
6. PHARMACEUTICAL PARTICULARS 6.1 List of excipients Water for injections Sodium hydroxide (for pH adjustment) Concentrated phosphoric acid (for pH adjustment) 6.2 Incompatibilities In the absence of compatibility studies, this medicinal product must not be mixed with other medicinal products. 6.3 Shelf life The expiry date of the product is indicated on the packaging materials 6.4 Special precautions for storage Store below 30°c. Do not freeze. LEQ API OCT22 V2 EU SmPC 08.2022 6.5 Nature and contents of container Pre-filled syringe 1.5 ml solution in a pre-filled syringe (Type I glass) with plunger stopper (bromobutyl, fluorotec coated rubber) with needle and rigid needle shield. Pack size of one pre-filled syringe. Pre-filled syringe with needle guard 1.5 ml solution in a pre-filled syringe (Type I glass) with plunger stopper (bromobutyl, fluorotec coated rubber), with needle and rigid needle shield, with needle guard. Pack size of one pre-filled syringe with needle guard. Not all pack sizes may be marketed. 6.6 Special precautions for disposal Leqvio should be inspected visually prior to administration. The solution should be clear, colourless to pale yellow and essentially free of particulates. If the solution contains visible particulate matter, the solution should not be used. Any unused medicinal product or waste material should be disposed of in accordance with local requirements. 7. REGISTRATION HOLDER AND IMPORTER NOVARTIS ISRAEL LTD POB 7126, Tel-Aviv

פרטי מסגרת הכללה בסל
א. התרופה תינתן לטיפול בהיפרכולסטרולמיה בחולים עם מחלה קרדיווסקולרית ידועה שחוו אוטם שריר הלב או שבץ מוחי איסכמי לא אמבולי בשלוש השנים טרם ההערכה וערכי ה-LDL שלהם מעל 100 מ"ג/דצ"ל, למרות טיפול מרבי בסטטינים בשילוב עם Ezetimibe, למשך חודשיים לפחות. ב. תחילת הטיפול בתרופה תיעשה לפי מרשם של רופא מומחה בקרדיולוגיה או רופא מומחה בליפידים או רופא מומחה בנוירולוגיה.
שימוש לפי פנקס קופ''ח כללית 1994
לא צוין
תאריך הכללה מקורי בסל
03/02/2022
הגבלות
תרופה מוגבלת לרישום ע'י רופא מומחה או הגבלה אחרת
מידע נוסף
עלון מידע לצרכן
20.10.21 - עלון לצרכן אנגלית 20.10.21 - עלון לצרכן עברית 20.10.21 - עלון לצרכן ערבית 03.11.22 - עלון לצרכן עברית 03.01.23 - עלון לצרכן אנגלית 03.01.23 - עלון לצרכן עברית 03.01.23 - עלון לצרכן ערבית 01.01.24 - עלון לצרכן עברית 28.06.24 - עלון לצרכן עברית 25.07.24 - עלון לצרכן אנגלית 25.07.24 - עלון לצרכן עברית 25.07.24 - עלון לצרכן ערבית 28.07.24 - עלון לצרכן אנגלית 28.07.24 - עלון לצרכן עברית 28.07.24 - עלון לצרכן ערבית 20.10.21 - החמרה לעלון 03.11.22 - החמרה לעלון 27.06.24 - החמרה לעלוןלתרופה במאגר משרד הבריאות
לקוויו 284מ"ג