Quest for the right Drug
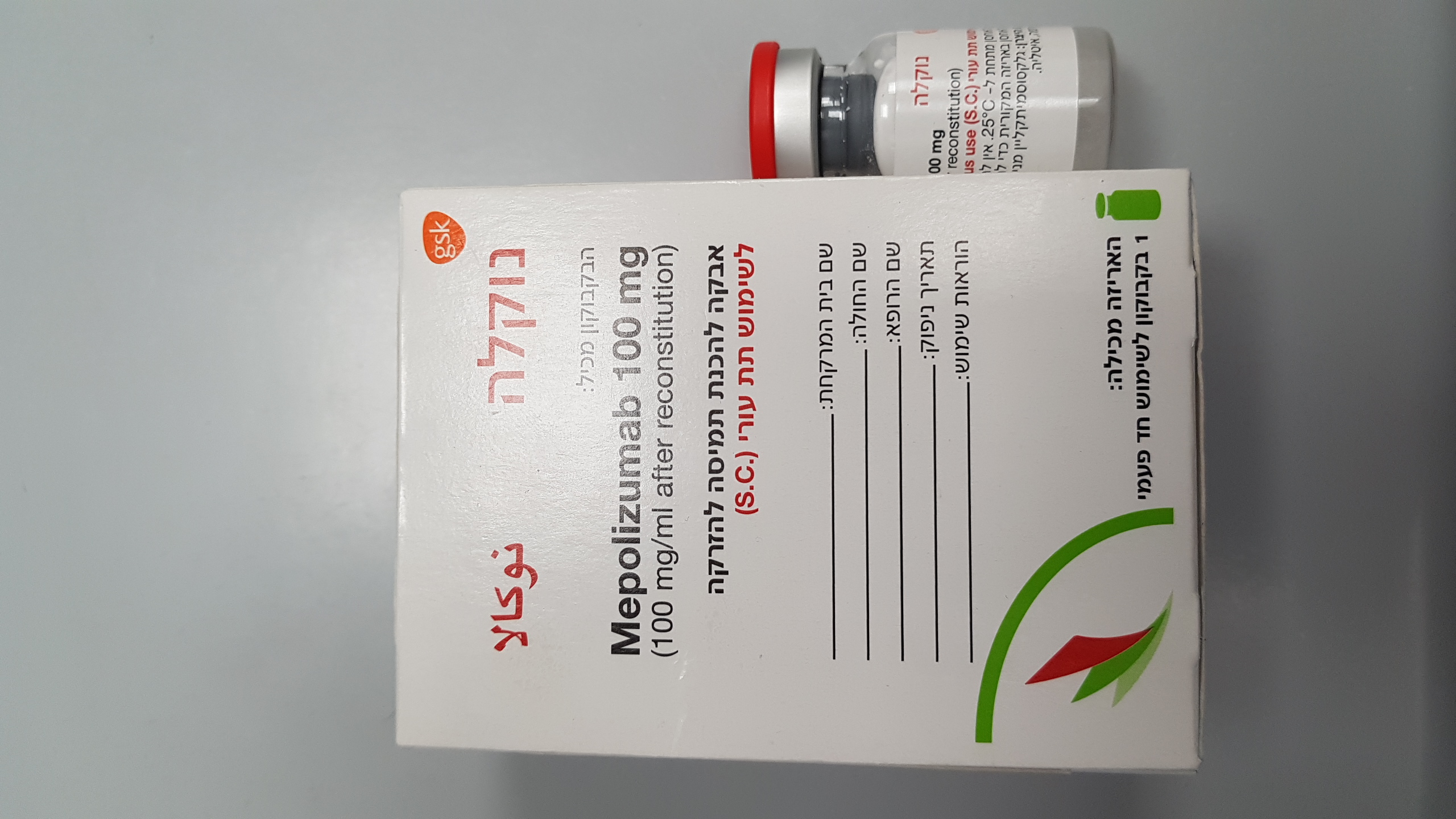
נוקלה אבקה להכנת תמיסה להזרקה NUCALA POWDER FOR SOLUTION FOR INJECTION (MEPOLIZUMAB)
תרופה במרשם
תרופה בסל
נרקוטיקה
ציטוטוקסיקה
צורת מתן:
תת-עורי : S.C
צורת מינון:
אבקה להכנת תמיסה לזריקה : POWDER FOR SOLUTION FOR INJECTION
עלון לרופא
מינוניםPosology התוויות
Indications תופעות לוואי
Adverse reactions התוויות נגד
Contraindications אינטראקציות
Interactions מינון יתר
Overdose הריון/הנקה
Pregnancy & Lactation אוכלוסיות מיוחדות
Special populations תכונות פרמקולוגיות
Pharmacological properties מידע רוקחי
Pharmaceutical particulars אזהרת שימוש
Special Warning עלון לרופא
Physicians Leaflet
Adverse reactions : תופעות לוואי
4.8 Undesirable effects Summary of the safety profile Severe eosinophilic asthma In placebo-controlled studies in subjects with severe refractory eosinophilic asthma, the most commonly reported adverse reactions during treatment were headache (20%), injection site reactions (8%) and back pain (6%). CRSwNP In a placebo-controlled study in patients with CRSwNP, the most commonly reported adverse reactions during treatment were headache (18%) and back pain (7%). EGPA In a placebo-controlled study in patients with EGPA, the most commonly reported adverse reactions during treatment were headache (32%), injection site reactions (15%) and back pain (13%). Systemic allergic/hypersensitivity reactions were reported by 4% of EGPA patients. HES In a placebo-controlled study in patients with HES, the most commonly reported adverse reactions during treatment were headache (13%), urinary tract infection (9%), injection site reactions and pyrexia (7% each). Tabulated list of adverse reactions The table below presents the adverse reactions from placebo-controlled severe eosinophilic asthma studies from patients receiving mepolizumab 100 mg subcutaneously (SC) (n=263), from a randomised, double- blind placebo-controlled 52-week study in patients with CRSwNP receiving mepolizumab 100 mg SC (n=206), in patients with EGPA receiving mepolizumab 300 mg SC (n=68), in a double-blind placebo- controlled 32-week study in patients with HES receiving mepolizumab 300 mg SC (n= 54), and from spontaneous post-marketing reports. Safety data is also available from open-label extension studies in severe refractory eosinophilic asthma patients (n=998) treated for a median of 2.8 years (range 4 weeks to 4.5 years). The safety profile of mepolizumab in HES patients (n=102) enrolled in a 20-week open label extension study was similar to the safety profile of patients in the pivotal placebo-controlled study. The frequency of adverse reactions is defined using the following convention: very common (≥1/10); common (≥1/100 to <1/10); uncommon (≥1/1,000 to <1/100); rare (≥1/10,000 to <1/1,000); very rare (<1/10,000); and not known (cannot be estimated from available data). Within each frequency grouping, adverse reactions are presented in order of decreasing seriousness. System Organ Class Adverse reactions Frequency Infections and infestations Lower respiratory tract infection Common Urinary tract infection Pharyngitis Herpes zoster** Uncommon Immune system disorders Hypersensitivity reactions (systemic Common allergic)* Anaphylaxis** Rare Nervous system disorders Headache Very common Respiratory, thoracic and Nasal congestion Common mediastinal disorders Gastrointestinal disorders Abdominal pain upper Common Skin and subcutaneous tissue Eczema Common disorders System Organ Class Adverse reactions Frequency Musculoskeletal and Back pain Common connective tissue disorders Arthralgia** General disorders and Administration-related reactions (systemic Common administration site conditions non allergic)*** Local injection site reactions Pyrexia * Systemic reactions including hypersensitivity have been reported at an overall incidence comparable to that of placebo in the severe eosinophilic asthma studies. For examples of the associated manifestations reported and a description of the time to onset, see section 4.4. **From spontaneous post marketing reporting. *** The most common manifestations associated with reports of systemic non-allergic administration-related reactions from patients in the severe eosinophilic asthma studies were rash, flushing and myalgia; these manifestations were reported infrequently and in <1% of patients receiving mepolizumab 100 mg subcutaneously. Description of selected adverse reactions Systemic reactions, including hypersensitivity reactions, in CRSwNP In the 52-week placebo-controlled study, systemic allergic (type I hypersensitivity) reactions were reported in 2 patients (<1%) in the group receiving mepolizumab 100 mg and in no patients in the placebo group. Other systemic reactions were reported by no patients in the group receiving mepolizumab 100 mg and in 1 patient (<1%) in the placebo group. Systemic reactions, including hypersensitivity reactions, in EGPA In the 52-week placebo-controlled study the percentage of patients who experienced systemic (allergic and non-allergic) reactions was 6% in the group receiving 300 mg of mepolizumab and 1% in the placebo group. Systemic allergic/hypersensitivity reactions were reported by 4% of patients in the group receiving 300 mg of mepolizumab and 1% of patients in the placebo group. Systemic non-allergic reactions (angioedema) were reported by 1 (1%) patient in the group receiving 300 mg of mepolizumab and no patients in the placebo group. Systemic reactions, including hypersensitivity reactions, in HES In the 32-week placebo-controlled study, 1 patient (2%) reported a systemic (other) reaction in the group receiving 300 mg of mepolizumab (multifocal skin reaction) and no patients in the placebo group. Local injection site reactions Severe eosinophilic asthma In placebo-controlled studies the incidence of local injection site reactions with mepolizumab 100 mg subcutaneous and placebo was 8% and 3%, respectively. These events were all non-serious, mild to moderate in intensity and the majority resolved within a few days. Local injection site reactions occurred mainly at the start of treatment and within the first 3 injections with fewer reports on subsequent injections. The most common manifestations reported with these events included pain, erythema, swelling, itching, and burning sensation. CRSwNP In the placebo-controlled study, local injection site reactions (e.g., erythema, pruritus) occurred in 2% of patients receiving mepolizumab 100 mg compared with <1% in patients receiving placebo. EGPA In the placebo-controlled study, local injection site reactions (e.g., pain, erythema, swelling) occurred at a rate of 15% in patients receiving mepolizumab 300 mg compared with 13% in patients receiving placebo. HES In the placebo-controlled study, local injection site reactions (e.g., burning, itching) occurred at a rate of 7% in patients receiving mepolizumab 300 mg compared with 4% in patients receiving placebo. Special data from clinical studies: HES Haemorrhage In phase 3 placebo-controlled study 200622, a higher number of subjects reporting hemorrhages was observed for mepolizumab 300 mg SC group (10/54 patients, 19%) compared to the placebo arm, (4/54 patients, 7%). The majority of cases were mild or moderate in intensity and resolved. Five out of 10 of the patients treated with mepolizumab had concomitant medications that could increase the risk of bleeding (including anticoagulants). No causal relationship with mepolizumab has been determined yet. Paediatric population Nucala is not indicated for children and adolescents under 18 years of age. Reporting of suspected adverse reactions Reporting suspected adverse reactions after authorisation of the medicinal product is important. It allows continued monitoring of the benefit/risk balance of the medicinal product. Any suspected adverse events should be reported to the Ministry of Health according to the National Regulation by using an online form https://sideeffects.health.gov.il Additionally, you should also report to GSK Israel (il.safety@gsk.com)

פרטי מסגרת הכללה בסל
א. התרופה תינתן לטיפול במקרים האלה:1. אסתמה אאוזינופילית חמורה בחולים בני 12 שנים ומעלה העונים על כל אלה: א. אסתמה בדרגת חומרה קשה (על פי הנחיות GINA) שאובחנה ע"י מומחה ברפואת ריאות או רופא מומחה באלרגיה ואימונולוגיה קלינית, המוגדרת לפי שימוש קבוע ב-ICS במינון גבוה (על פי הנחיות GINA) יחד עם תרופה שנייה, בדרך כלל LABA. ב. עונים על אחד מאלה:א. אאוזינופיליה בדם ברמה של 400 תאים פר מיקרוליטר ומעלה בשתי בדיקות דם מהשנתיים האחרונות, אשר עונים על לפחות אחד מאלה:1. שתי החמרות או יותר אשר לפחות אחת מהן הצריכה פניה למיון או אשפוז בשנה האחרונה עקב אסתמה לא מאוזנת.2. שלוש החמרות או יותר בשנה האחרונה שנזקקו לטיפול בסטרואידים סיסטמיים במשך לפחות שלושה ימים. 3. חולי אסתמה הזקוקים לטיפול קבוע בקורטיקוסטרואידים במתן פומי למשך לפחות 50% מהזמן במטרה לשלוט במחלה. ב. אאוזינופיליה בדם ברמה של 400 תאים פר מיקרוליטר ומטה, בשתי בדיקות דם מהשנתיים האחרונות המטופלים באופן קבוע בקורטיקוסטרואידים במתן פומי (מינון קבוע תואם 5 מ"ג ומעלה פרדניזון ליום או שימוש בקורטיקוסטרואידים במינון של מעל 5 מ"ג ומעלה פרדניזון ליום למשך לפחות ששה חודשים בשנה (לתקופה רציפה או לא רציפה שקדמה לתחילת הטיפול)) במטרה לשלוט במחלה. ג. הטיפול לא יינתן בשילוב עם Dupilumab או בשילוב עם Omalizumab.ד. הטיפול בתרופה האמור ייעשה לפי מרשם של רופא מומחה ברפואת ריאות או רופא מומחה באלרגיה ואימונולוגיה קלינית.2. Eosinophilc granulomatosis with polyangitis (EGPA) רפרקטורית או עם התלקחויות חוזרות בחולים בגירים העונים על כל אלה:א. עונה על כל אלה:1. מאובחן באסטמה המצוי במעקב מומחה ברפואת ריאות או מומחה באימונולוגיה קלינית או מומחה באלרגיה, שהוא בעל תפקודי נשיפה המדגימים חסימה הפיכה עפ"י הקריטריונים.2. אאוזינופיליה מתמדת (לפחות בדיקה אחת מעל 1500 תאים או מעל 10% מספירת התאים הלבנים).ב. עונה על שניים מהבאים:1. וסקוליטיס עם אאוזינופילים בדופן כלי הדם בביופסיה מאיבר כלשהו;2. גלומרולונפריטיס בביופסיית כליה או משקע שתן המתאים לגלומרולונפריטיס (גלילי RBC) ו/או אירוע מוכח של פריקרדיטיס (ע"פ קליניקה, מדדי דלקת, אק"ג ואקו לב) / מיוקרדיטיס (כנ"ל, לרבות טרופונין חיובי) או MI (עם הוכחה של דלקת בכלי הדם הכליליים);3. דימום אלוואולרי או הצללות מפוזרות בריאות (לא כולל תסנינים ריאתיים למעט תסנינים מפוזרים שהודגמו על ידי 3 בדיקות הדמיה עוקבות וללא עדות למחלה זיהומית בה בעת);4. בדיקת p-ANCA חיובית;5. נוירופתיה מסוג mononeuritis multiplex או simplex;6. סינוסיטיס כרונית עם פוליפים נזלים.ג. לאחר כשלון בטיפול בגלוקוקורטיקואידים (במינון מעל 7.5 מ"ג) למשך שלושה חודשים לפחות.לעניין זו תוגדר מחלה רפרקטורית ככישלון להגיע להפוגה של המחלה לאחר טיפול מקובל למשך שלושה חודשים לפחות בזמן הורדת מינון הסטרואידים למנה של מתחת ל-7.5 מ"ג ליום. התלקחות תוגדר כצורך להעלות את מינון הסטרואידים הסיסטמיים, צורך להתחיל או לעלות מינון של טיפול אימונוסופרסיבי אחר, אשפוז עקב התלקחות של המחלה בשנתיים האחרונות.ד. הטיפול בתרופה האמורה ייעשה לפי מרשם של רופא מומחה ברפואת ריאות או רופא מומחה באלרגיה ואימונולוגיה קלינית או רופא מומחה בראומטולוגיה.3. טיפול בתסמונת היפראאוזינופילית (Hypereosinophilic syndrome (HES)) א. הטיפול יינתן לחולים העונים על כל אלה:1. לפחות 6 חודשים מאבחון התסמונת.2. תסמונת לא מבוקרת, ללא סיבה משנית לא המטולוגית.3. אאוזינופיליה בדם ברמה של 1,500 תאים/מיקרוליטר ומעלה בשתי בדיקות דם מהשנתיים האחרונות בהפרש של חודש לפחות בין בדיקה לבדיקה.4. עדות לפגיעה, עקב רמות אאוזינופילים גבוהות, באיבר או ברקמה, אשר תוארו ב-HES, כגון לב, עור, ריאות, מערכת העיכול ומערכת העצבים.במקרה של מחלה ריאתית שיכולה להתאים לאסטמה תידרש עדות לפגיעה במערכת נוספת כגון עור, לב, מערכת העיכול או מערכת העצבים.5. לאחר כישלון להשגת הפוגה של המחלה או התלקחות המחלה לאחר טיפול מקובל בסטרואידים למשך שלושה חודשים לפחות בזמן הורדת מינון הסטרואידים למנה של מתחת ל-7.5 מ"ג ליום. לעניין זה תוגדר התלקחות כאחד מאלה:א. צורך להעלות מינון סטרואידים סיסטמייםב. צורך להתחיל או להעלות מינון של טיפול אימונוסופרסיבי אחרג. אשפוז עקב התלקחות של המחלה בשנתיים האחרונות.סעיף זה לא יחול על חולים עם HES ומחלה מטבולית, בהם שימוש בסטרואידים סיסטמיים במינון גבוה עשוי להיות מסוכן, ועל כן אין להתנות טיפול במפוליזומאב לאחר הוכחת כישלון בטיפול בסטרואידים.ב. הטיפול בתרופה האמורה ייעשה לפי מרשם של רופא מומחה באלרגיה ואימונולוגיה קלינית או בראומטולוגיה.
מסגרת הכללה בסל
התוויות הכלולות במסגרת הסל
| התוויה | תאריך הכללה | תחום קליני | Class Effect | מצב מחלה |
|---|---|---|---|---|
| Eosinophilc granulomatosis with polyangitis (EGPA) רפרקטורית או עם התלקחויות חוזרות בחולים בגירים העונים על כל אלה: 1. עונה על כל אלה: א. מאובחן באסטמה המצוי במעקב מומחה ברפואת ריאות או מומחה באימונולוגיה קלינית או מומחה באלרגיה, שהוא בעל תפקודי נשיפה המדגימים חסימה הפיכה עפ"י הקריטריונים. ב. אאוזינופיליה מתמדת (לפחות בדיקה אחת מעל 1500 תאים או מעל 10% מספירת התאים הלבנים). 2. עונה על שניים מהבאים: א. וסקוליטיס עם אאוזינופילים בדופן כלי הדם בביופסיה מאיבר כלשהו; ב. גלומרולונפריטיס בביופסיית כליה או משקע שתן המתאים לגלומרולונפריטיס (גלילי RBC) ו/או אירוע מוכח של פריקרדיטיס (ע"פ קליניקה, מדדי דלקת, אק"ג ואקו לב) / מיוקרדיטיס (כנ"ל, לרבות טרופונין חיובי) או MI (עם הוכחה של דלקת בכלי הדם הכליליים); ג. דימום אלוואולרי או הצללות מפוזרות בריאות (לא כולל תסנינים ריאתיים למעט תסנינים מפוזרים שהודגמו על ידי 3 בדיקות הדמיה עוקבות וללא עדות למחלה זיהומית בה בעת); ד. בדיקת p-ANCA חיובית; ה. נוירופתיה מסוג mononeuritis multiplex או simplex; ו. סינוסיטיס כרונית עם פוליפים נזלים. 3. לאחר כשלון בטיפול בגלוקוקורטיקואידים (במינון מעל 7.5 מ"ג) למשך שלושה חודשים לפחות. לעניין זו תוגדר מחלה רפרקטורית ככישלון להגיע להפוגה של המחלה לאחר טיפול מקובל למשך שלושה חודשים לפחות בזמן הורדת מינון הסטרואידים למנה של מתחת ל-7.5 מ"ג ליום. התלקחות תוגדר כצורך להעלות את מינון הסטרואידים הסיסטמיים, צורך להתחיל או לעלות מינון של טיפול אימונוסופרסיבי אחר, אשפוז עקב התלקחות של המחלה בשנתיים האחרונות. 4. הטיפול בתרופה האמורה ייעשה לפי מרשם של רופא מומחה ברפואת ריאות או רופא מומחה באלרגיה ואימונולוגיה קלינית או רופא מומחה בראומטולוגיה. | 16/01/2019 | אלרגיה ואימונולוגיה קלינית | Eosinophilc granulomatosis with polyangitis, EGPA | |
| 1. אסתמה אאוזינופילית חמורה בחולים בני 12 שנים ומעלה העונים על כל אלה: א. אסתמה בדרגת חומרה קשה (על פי הנחיות GINA) שאובחנה ע"י מומחה ברפואת ריאות או רופא מומחה באלרגיה ואימונולוגיה קלינית, המוגדרת לפי שימוש קבוע ב-ICS במינון גבוה (על פי הנחיות GINA) יחד עם תרופה שנייה, בדרך כלל LABA. ב. אאוזינופיליה בדם ברמה של 400 תאים פר מיקרוליטר ומעלה בשתי בדיקות דם מהשנתיים האחרונות. ג. חולי אסתמה עם לפחות אחד מאלה: 1. שתי החמרות או יותר אשר לפחות אחת מהן הצריכה פניה למיון או אשפוז בשנה האחרונה עקב אסתמה לא מאוזנת. 2. שלוש החמרות או יותר בשנה האחרונה שנזקקו לטיפול בסטרואידים סיסטמיים במשך לפחות שלושה ימים. 3. חולי אסטמה הזקוקים לטיפול קבוע בקורטיקוסטרואידים במתן פומי למשך לפחות 50% מהזמן במטרה לשלוט במחלה. ד. בחולים העומדים במסגרת ההכללה בסל של Omalizumab (תבחיני עור או specific IGE חיובי) וכן במסגרת ההכללה בסל המפורטת לעיל לגבי Mepolizumab או Reslizumab או Benralizumab– תינתן התרופה Omalizumab כקו טיפול ראשון.. חולים אטופיים עם אאוזינופיליה ברמה של 400 תאים פר מיקרוליטר ומעלה אשר נכשלו או לא סבלו טיפול ב-Omalizumab יהיו זכאים לקבל תרופות מקבוצה זו אם עונים להגדרות סעיף א. הטיפול בתרופה האמור ייעשה לפי מרשם של רופא מומחה ברפואת ריאות או רופא מומחה באלרגיה ואימונולוגיה קלינית | 11/01/2018 | רפואת ריאות | אסטמה אאוזינופילית | |
| 1. אסתמה אאוזינופילית חמורה בחולים בני 12 שנים ומעלה העונים על כל אלה: א. אסתמה בדרגת חומרה קשה (על פי הנחיות GINA) שאובחנה ע"י מומחה ברפואת ריאות או רופא מומחה באלרגיה ואימונולוגיה קלינית, המוגדרת לפי שימוש קבוע ב-ICS במינון גבוה (על פי הנחיות GINA) יחד עם תרופה שנייה, בדרך כלל LABA. ב. עונים על אחד מאלה: א. אאוזינופיליה בדם ברמה של 400 תאים פר מיקרוליטר ומעלה בשתי בדיקות דם מהשנתיים האחרונות, אשר עונים על לפחות אחד מאלה: 1. שתי החמרות או יותר אשר לפחות אחת מהן הצריכה פניה למיון או אשפוז בשנה האחרונה עקב אסתמה לא מאוזנת. 2. שלוש החמרות או יותר בשנה האחרונה שנזקקו לטיפול בסטרואידים סיסטמיים במשך לפחות שלושה ימים. 3. חולי אסתמה הזקוקים לטיפול קבוע בקורטיקוסטרואידים במתן פומי למשך לפחות 50% מהזמן במטרה לשלוט במחלה. ב. אאוזינופיליה בדם ברמה של 400 תאים פר מיקרוליטר ומטה, בשתי בדיקות דם מהשנתיים האחרונות המטופלים באופן קבוע בקורטיקוסטרואידים במתן פומי (מינון קבוע תואם 5 מ"ג ומעלה פרדניזון ליום או שימוש בקורטיקוסטרואידים במינון של מעל 5 מ"ג ומעלה פרדניזון ליום למשך לפחות ששה חודשים בשנה (לתקופה רציפה או לא רציפה שקדמה לתחילת הטיפול)) במטרה לשלוט במחלה. ג. הטיפול לא יינתן בשילוב עם Dupilumab או בשילוב עם Omalizumab. ד. הטיפול בתרופה האמור ייעשה לפי מרשם של רופא מומחה ברפואת ריאות או רופא מומחה באלרגיה ואימונולוגיה קלינית | 01/03/2021 | רפואת ריאות | אסטמה אאוזינופילית | |
| 3. טיפול בתסמונת היפראאוזינופילית (Hypereosinophilic syndrome (HES)) א. הטיפול יינתן לחולים העונים על כל אלה: 1. לפחות 6 חודשים מאבחון התסמונת. 2. תסמונת לא מבוקרת, ללא סיבה משנית לא המטולוגית. 3. אאוזינופיליה בדם ברמה של 1,500 תאים/מיקרוליטר ומעלה בשתי בדיקות דם מהשנתיים האחרונות בהפרש של חודש לפחות בין בדיקה לבדיקה. 4. עדות לפגיעה, עקב רמות אאוזינופילים גבוהות, באיבר או ברקמה, אשר תוארו ב-HES, כגון לב, עור, ריאות, מערכת העיכול ומערכת העצבים. במקרה של מחלה ריאתית שיכולה להתאים לאסטמה תידרש עדות לפגיעה במערכת נוספת כגון עור, לב, מערכת העיכול או מערכת העצבים. 5. לאחר כישלון להשגת הפוגה של המחלה או התלקחות המחלה לאחר טיפול מקובל בסטרואידים למשך שלושה חודשים לפחות בזמן הורדת מינון הסטרואידים למנה של מתחת ל-7.5 מ"ג ליום. לעניין זה תוגדר התלקחות כאחד מאלה: א. צורך להעלות מינון סטרואידים סיסטמיים ב. צורך להתחיל או להעלות מינון של טיפול אימונוסופרסיבי אחר ג. אשפוז עקב התלקחות של המחלה בשנתיים האחרונות. סעיף זה לא יחול על חולים עם HES ומחלה מטבולית, בהם שימוש בסטרואידים סיסטמיים במינון גבוה עשוי להיות מסוכן, ועל כן אין להתנות טיפול במפוליזומאב לאחר הוכחת כישלון בטיפול בסטרואידים. ב. הטיפול בתרופה האמורה ייעשה לפי מרשם של רופא מומחה באלרגיה ואימונולוגיה קלינית או בראומטולוגיה. | 03/02/2022 | אלרגיה ואימונולוגיה קלינית | Hypereosinophilic syndrome | |
| א. התרופה תינתן לטיפול במקרים האלה: 1. אסתמה אאוזינופילית חמורה בחולים בני 12 שנים ומעלה העונים על כל אלה: א. אסתמה בדרגת חומרה קשה (על פי הנחיות GINA) שאובחנה ע"י רופא מומחה ברפואת ריאות או רופא מומחה באלרגיה ואימונולוגיה קלינית, המוגדרת לפי שימוש קבוע ב-ICS במינון גבוה (על פי הנחיות GINA) יחד עם תרופה שנייה, בדרך כלל LABA. ב. עונים על אחד מאלה: 1. אאוזינופיליה בדם ברמה של 150-300 או 400 תאים פר מיקרוליטר ומעלה בשתי בדיקות דם מהשנתיים האחרונות, אשר עונים על לפחות אחד מאלה: א. שתי החמרות או יותר אשר לפחות אחת מהן הצריכה פניה למיון או אשפוז בשנה האחרונה עקב אסתמה לא מאוזנת. ב. שלוש החמרות או יותר בשנה האחרונה שנזקקו לטיפול בסטרואידים סיסטמיים במשך לפחות שלושה ימים. ג. חולי אסתמה הזקוקים לטיפול קבוע בקורטיקוסטרואידים במתן פומי למשך לפחות 50% מהזמן במטרה לשלוט במחלה. 2. אאוזינופיליה בדם ברמה של 400 תאים פר מיקרוליטר ומטה, בשתי בדיקות דם מהשנתיים האחרונות המטופלים באופן קבוע בקורטיקוסטרואידים במתן פומי (מינון קבוע תואם 5 מ"ג ומעלה פרדניזון ליום או שימוש בקורטיקוסטרואידים במינון של מעל 5 מ"ג ומעלה פרדניזון ליום למשך לפחות ששה חודשים בשנה (לתקופה רציפה או לא רציפה שקדמה לתחילת הטיפול)) במטרה לשלוט במחלה. 2. הטיפול לא יינתן בשילוב עם Dupilumab או בשילוב עם Omalizumab. 3. הטיפול בתרופה האמורה ייעשה לפי מרשם של רופא מומחה ברפואת ריאות או רופא מומחה באלרגיה ואימונולוגיה קלינית. ב. Eosinophilc granulomatosis with polyangitis (EGPA) רפרקטורית או עם התלקחויות חוזרות בחולים בגירים העונים על כל אלה: א. עונה על כל אלה: 1. מאובחן באסתמה המצוי במעקב רופא מומחה ברפואת ריאות או רופא מומחה באימונולוגיה קלינית או רופא מומחה באלרגיה, שהוא בעל תפקודי נשיפה המדגימים חסימה הפיכה עפ"י הקריטריונים. 2. אאוזינופיליה מתמדת (לפחות בדיקה אחת מעל 1,500 תאים או מעל 10% מספירת התאים הלבנים). ב. עונה על שניים מהבאים: 1. וסקוליטיס עם אאוזינופילים בדופן כלי הדם בביופסיה מאיבר כלשהו; 2. גלומרולונפריטיס בביופסיית כליה או משקע שתן המתאים לגלומרולונפריטיס (גלילי RBC) ו/או אירוע מוכח של פריקרדיטיס (ע"פ קליניקה, מדדי דלקת, אק"ג ואקו לב) / מיוקרדיטיס (כנ"ל, לרבות טרופונין חיובי) או MI (עם הוכחה של דלקת בכלי הדם הכליליים); 3. דימום אלוואולרי או הצללות מפוזרות בריאות (לא כולל תסנינים ריאתיים למעט תסנינים מפוזרים שהודגמו על ידי 3 בדיקות הדמיה עוקבות וללא עדות למחלה זיהומית בה בעת); 4. בדיקת p-ANCA חיובית; 5. נוירופתיה מסוג mononeuritis multiplex או simplex; 6. סינוסיטיס כרונית עם פוליפים נזלים. ג. לאחר כשלון בטיפול בגלוקוקורטיקואידים (במינון מעל 7.5 מ"ג) למשך שלושה חודשים לפחות. לעניין זו תוגדר מחלה רפרקטורית ככישלון להגיע להפוגה של המחלה לאחר טיפול מקובל למשך שלושה חודשים לפחות בזמן הורדת מינון הסטרואידים למנה של מתחת ל-7.5 מ"ג ליום. התלקחות תוגדר כצורך להעלות את מינון הסטרואידים הסיסטמיים, צורך להתחיל או לעלות מינון של טיפול אימונוסופרסיבי אחר, אשפוז עקב התלקחות של המחלה בשנתיים האחרונות. ד. הטיפול בתרופה האמורה ייעשה לפי מרשם של רופא מומחה ברפואת ריאות או רופא מומחה באלרגיה ואימונולוגיה קלינית או רופא מומחה בראומטולוגיה. | 17/03/2024 | רפואת ריאות | אסתמה אאוזינופילית |
שימוש לפי פנקס קופ''ח כללית 1994
לא צוין
תאריך הכללה מקורי בסל
17/03/2024
הגבלות
תרופה מוגבלת לרישום ע'י רופא מומחה או הגבלה אחרת
מידע נוסף
עלון מידע לצרכן
27.04.21 - עלון לצרכן אנגלית 30.08.22 - עלון לצרכן עברית 27.04.21 - עלון לצרכן ערבית 02.10.22 - עלון לצרכן אנגלית 02.10.22 - עלון לצרכן עברית 02.10.22 - עלון לצרכן ערבית 16.09.24 - עלון לצרכן עברית 18.12.18 - החמרה לעלון 03.12.20 - החמרה לעלון 01.06.22 - החמרה לעלון 30.08.22 - החמרה לעלון 16.09.24 - החמרה לעלוןלתרופה במאגר משרד הבריאות
נוקלה אבקה להכנת תמיסה להזרקה