Quest for the right Drug
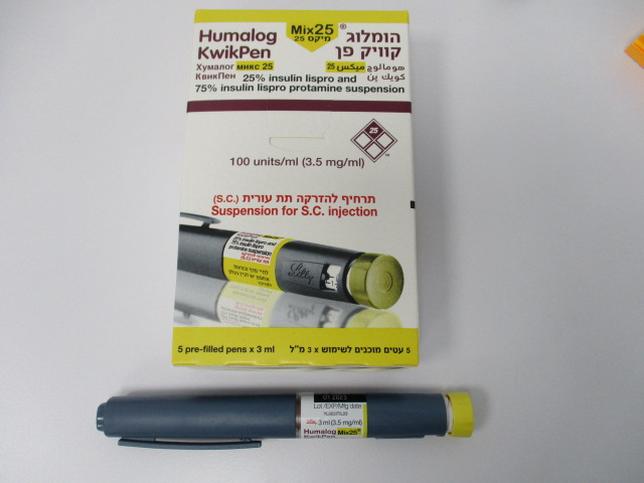
הומלוג מיקס 25 קוויק פן HUMALOG MIX 25 KWIKPEN (INSULIN LISPRO, INSULIN LISPRO AS PROTAMINE)
תרופה במרשם
תרופה בסל
נרקוטיקה
ציטוטוקסיקה
צורת מתן:
תת-עורי : S.C
צורת מינון:
תרחיף להזרקה : SUSPENSION FOR INJECTION
עלון לרופא
מינוניםPosology התוויות
Indications תופעות לוואי
Adverse reactions התוויות נגד
Contraindications אינטראקציות
Interactions מינון יתר
Overdose הריון/הנקה
Pregnancy & Lactation אוכלוסיות מיוחדות
Special populations תכונות פרמקולוגיות
Pharmacological properties מידע רוקחי
Pharmaceutical particulars אזהרת שימוש
Special Warning עלון לרופא
Physicians Leaflet
Pharmaceutical particulars : מידע רוקחי
6. PHARMACEUTICAL PARTICULARS 6.1 List of excipients Humalog Mix 25 KwikPen Glycerol, dibasic sodium phosphate, metaCresol, liquefied phenol, zinc oxide, Protamine sulphate, water for injections. Hydrochloric acid and sodium hydroxide may have been used to adjust pH Humalog Mix 50 KwikPen Glycerol, dibasic sodium phosphate, metaCresol, liquefied phenol, Protamine sulphate, zinc oxide, water for injections. Hydrochloric acid and sodium hydroxide may have been used to adjust pH 6.2 Incompatibilities Mixing Humalog Mix 25 or Humalog Mix 50 with other insulins has not been studied. In the absence of compatibility studies, this medicinal product must not be mixed with other medicinal products. 6.3 Shelf life The expiry date of the product is indicated on the packaging materials. After first use 28 days. 6.4 Special precautions for storage Do not freeze. Do not expose to excessive heat or direct sunlight. Before use Store in a refrigerator (2°C - 8°C). After first use Store below 30°C. Do not refrigerate. The pre-filled pen should not be stored with the needle attached. 6.5 Nature and contents of container The suspension is contained in type I flint glass cartridges, sealed with halobutyl disc seals and plunger heads and secured with aluminium seals. Dimeticone or silicone emulsion may have been used to treat the cartridge plunger, and/or the glass cartridge. The 3 ml cartridges are sealed in a disposable pen injector, called the “KwikPen”. Needles are not included. Not all packs may be marketed. 5 x 3 ml Humalog Mix 25 100 units/ml KwikPens. 5 x 3 ml Humalog Mix 50 100 units/ml KwikPens. 6.6 Special precautions for disposal and other handling Instructions for use and handling To prevent the possible transmission of disease, each pen must be used by one patient only, even if the needle is changed. The Humalog Mix should be examined frequently and should not be used if clumps of material are present or if solid white particles stick to the bottom or wall of the container, giving it a frosted appearance. Preparing a dose The KwikPen should be rotated in the palms of the hands ten times and inverted 180° ten times immediately before use to resuspend the insulin until it appears uniformly cloudy or milky. If not, repeat the above procedure until contents are mixed. Cartridges contain a small glass bead to assist mixing. Do not shake vigorously as this may cause frothing which may interfere with the correct measurement of the dose. Before using the KwikPen the user manual included in the package leaflet must be read carefully. The KwikPen has to be used as recommended in the user manual. Pens should not be used if any part looks broken or damaged. Injecting a dose If using a pre-filled or reusable pen refer to the detailed instructions for preparing the pen and injecting the dose, the following is a general description. 1. Wash your hands 2. Choose a site for injection. 3. Clean the skin as instructed. 4. Stabilise the skin by spreading it or pinching up a large area. Insert the needle and inject as instructed. 5. Pull the needle out and apply gentle pressure over the injection site for several seconds. Do not rub the area. 6. Using the outer needle cap, unscrew the needle and dispose of it safely. 7. Use of the injection sites should be rotated so that the same is not used more than approximately once a month. Any unused product or waste material should be disposed of in accordance with local requirements. 7. MANUFACTURER: Eli Lilly & Company Ltd., Indianapolis, Indiana, USA

מסגרת הכללה בסל
התוויות הכלולות במסגרת הסל
| התוויה | תאריך הכללה | תחום קליני | Class Effect | מצב מחלה |
|---|---|---|---|---|
| התרופה האמורה תינתן לטיפול בחולי סוכרת. | 09/03/1999 | מחלות מטבוליות | INSULIN ASPART, INSULIN LISPRO, INSULIN GLULISINE |
שימוש לפי פנקס קופ''ח כללית 1994
לא צוין
תאריך הכללה מקורי בסל
לא צוין
הגבלות
לא צוין
מידע נוסף
עלון מידע לרופא
13.07.21 - עלון לרופאעלון מידע לצרכן
03.06.20 - עלון לצרכן אנגלית 11.08.22 - עלון לצרכן אנגלית 03.06.20 - עלון לצרכן עברית 11.08.22 - עלון לצרכן עברית 03.06.20 - עלון לצרכן ערבית 11.08.22 - עלון לצרכן ערבית 19.01.22 - עלון לצרכן אנגלית 19.01.22 - עלון לצרכן עברית 19.01.22 - עלון לצרכן ערבית 03.06.20 - החמרה לעלון 03.06.20 - החמרה לעלון 03.06.20 - החמרה לעלון 03.06.20 - החמרה לעלון 10.11.20 - החמרה לעלון 08.06.15 - החמרה לעלוןלתרופה במאגר משרד הבריאות
הומלוג מיקס 25 קוויק פן