Quest for the right Drug
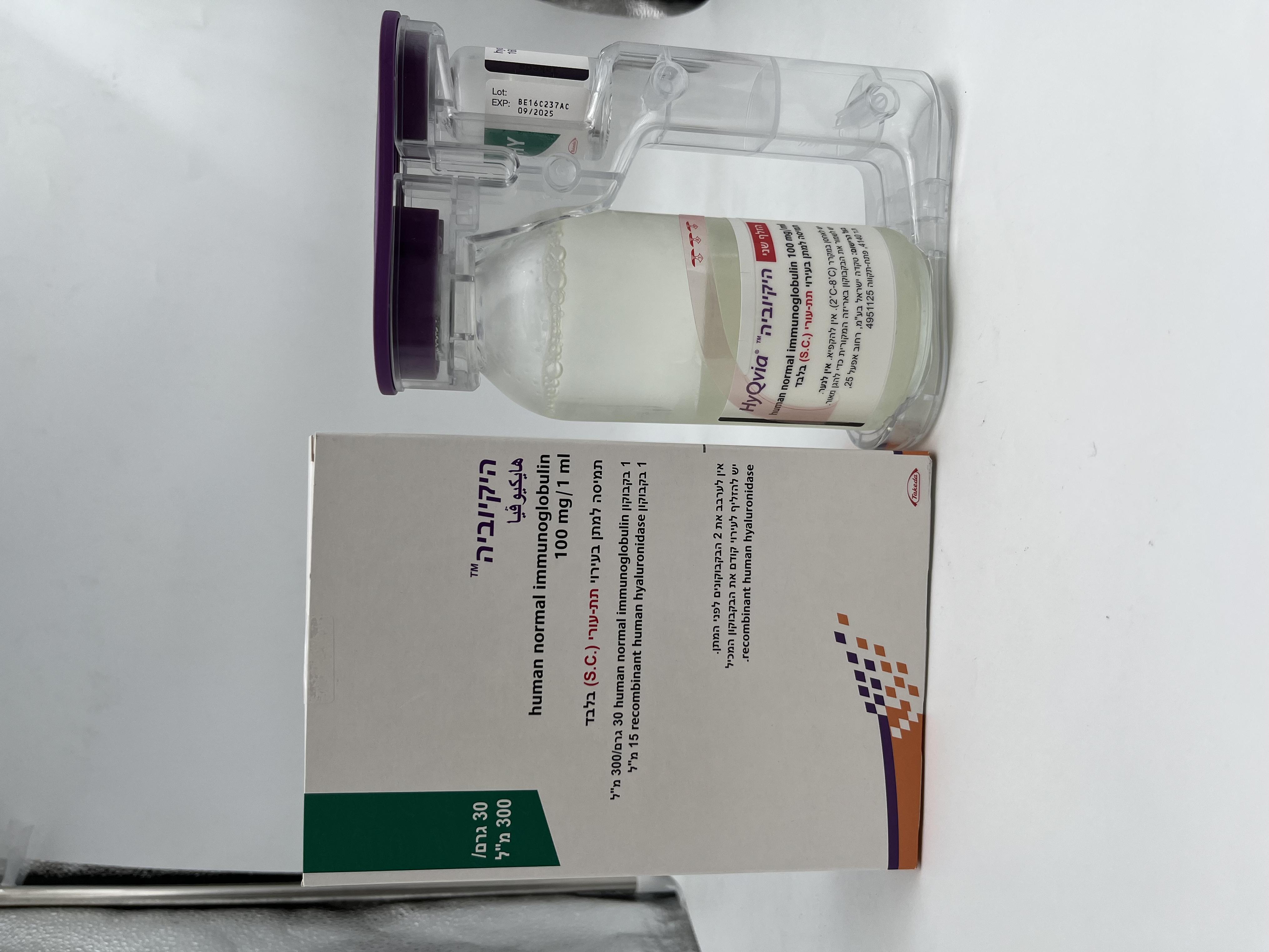
היקיוביה HYQVIA (HUMAN NORMAL IMMUNOGLOBULIN)
תרופה במרשם
תרופה בסל
נרקוטיקה
ציטוטוקסיקה
צורת מתן:
תת-עורי : S.C
צורת מינון:
תמיסה לאינפוזיה : SOLUTION FOR INFUSION
עלון לרופא
מינוניםPosology התוויות
Indications תופעות לוואי
Adverse reactions התוויות נגד
Contraindications אינטראקציות
Interactions מינון יתר
Overdose הריון/הנקה
Pregnancy & Lactation אוכלוסיות מיוחדות
Special populations תכונות פרמקולוגיות
Pharmacological properties מידע רוקחי
Pharmaceutical particulars אזהרת שימוש
Special Warning עלון לרופא
Physicians Leaflet
Pharmaceutical particulars : מידע רוקחי
6. PHARMACEUTICAL PARTICULARS 6.1 List of excipients Human normal immunoglobulin (IG 10%) vial Glycine Water for injection Recombinant human hyaluronidase (rHuPH20) vial Sodium chloride Sodium phosphate dibasic dihydrate Sodium hydroxide Human serum albumin, 25% Edetate disodium dihydrate (EDTA) Calcium chloride dihydrate 25% Hydrochloric acid Water for injection 6.2 Incompatibilities In the absence of compatibility studies, this medicinal product must not be mixed with other medicinal products. 6.3 Shelf life The expiry date of the product is indicated on the packaging materials. 6.4 Special precautions for storage Store in a refrigerator (2°C – 8°C). Do not freeze. Keep the vials in the outer carton in order to protect them from light. 6.5 Nature and contents of container Human normal immunoglobulin (IG 10%) vial 25, 50, 100, 200 or 300 mL of solution in a vial (Type I glass) with a stopper (bromobutyl rubber). Recombinant human hyaluronidase (rHuPH20) vial 1.25, 2.5, 5, 10 or 15 mL of solution in a vial (Type I glass) with a stopper (chlorobutyl rubber). Pack size: One vial of IG 10% and one vial of rHuPH20 in a dual vial unit. Not all pack sizes may be marketed. 6.6 Special precautions for disposal and other handling The medicinal product should be brought to room temperature before use. Do not use heating devices including microwaves. IG 10% is a clear or slightly opalescent and colourless or pale-yellow solution. rHuPH20is a clear, colourless solution. This medicinal product is comprised of 2 vials. Both vials should be inspected visually for particulate matter and discoloration prior to administration. Solutions that are cloudy or have deposits should not be used. Do not shake. Do not mix the components of HyQvia prior to administration. Do not use vented vial access devices to remove rHuPH20from vials. Use aseptic technique when preparing and administering HyQvia. In cases where more than one vial of the medicinal product IG 10% or rHuPH20 is required to obtain the required dose of the infusion, the IG 10% and/or rHuPH20should be prepared separately in appropriate solution containers before administration. Partially used vials should be discarded. Any unused product or waste material should be disposed of in accordance with local requirements.

פרטי מסגרת הכללה בסל
התרופה תינתן לטיפול במקרים האלה: א. חסר חיסוני ראשוני (חולים עם פגיעה ראשונית בייצור נוגדנים כגון אגמגלובולינמיה או היפוגמגלובוילינמיה, ITP (Idiopathic thrombocytopenic purpura)); ב. חסר חיסוני ספציפי, מניעה או טיפול בחצבת, הפטיטיס A ויראלית; ג. CIDP – Chronic inflammatory demyelineating polyneuropathy; ד.טיפול בחולי לוקמיה מסוג CLL הסובלים מהיפוגלמגלובולינמיה משנית חמורה וזיהומים חוזרים.
שימוש לפי פנקס קופ''ח כללית 1994
Primary immunodeficiency (patients with primary defective antibody synthesis such as agammaglobulinemia or hypogammaglobulinemia, idiopathic thrombocytopenic purpura (ITP)
תאריך הכללה מקורי בסל
01/01/1995
הגבלות
תרופה מוגבלת לשימוש בבתי חולים או אשפוז יום
מידע נוסף
עלון מידע לצרכן
18.11.21 - עלון לצרכן אנגלית 18.11.21 - עלון לצרכן עברית 18.11.21 - עלון לצרכן אנגלית 18.11.21 - עלון לצרכן עברית 15.06.21 - עלון לצרכן אנגלית 15.07.21 - עלון לצרכן עברית 15.06.21 - עלון לצרכן ערבית 06.11.22 - עלון לצרכן אנגלית 06.11.22 - עלון לצרכן עברית 06.11.22 - עלון לצרכן ערבית 12.10.23 - עלון לצרכן אנגלית 12.10.23 - עלון לצרכן עברית 12.10.23 - עלון לצרכן ערבית 14.09.22 - החמרה לעלוןלתרופה במאגר משרד הבריאות
היקיוביה