Quest for the right Drug
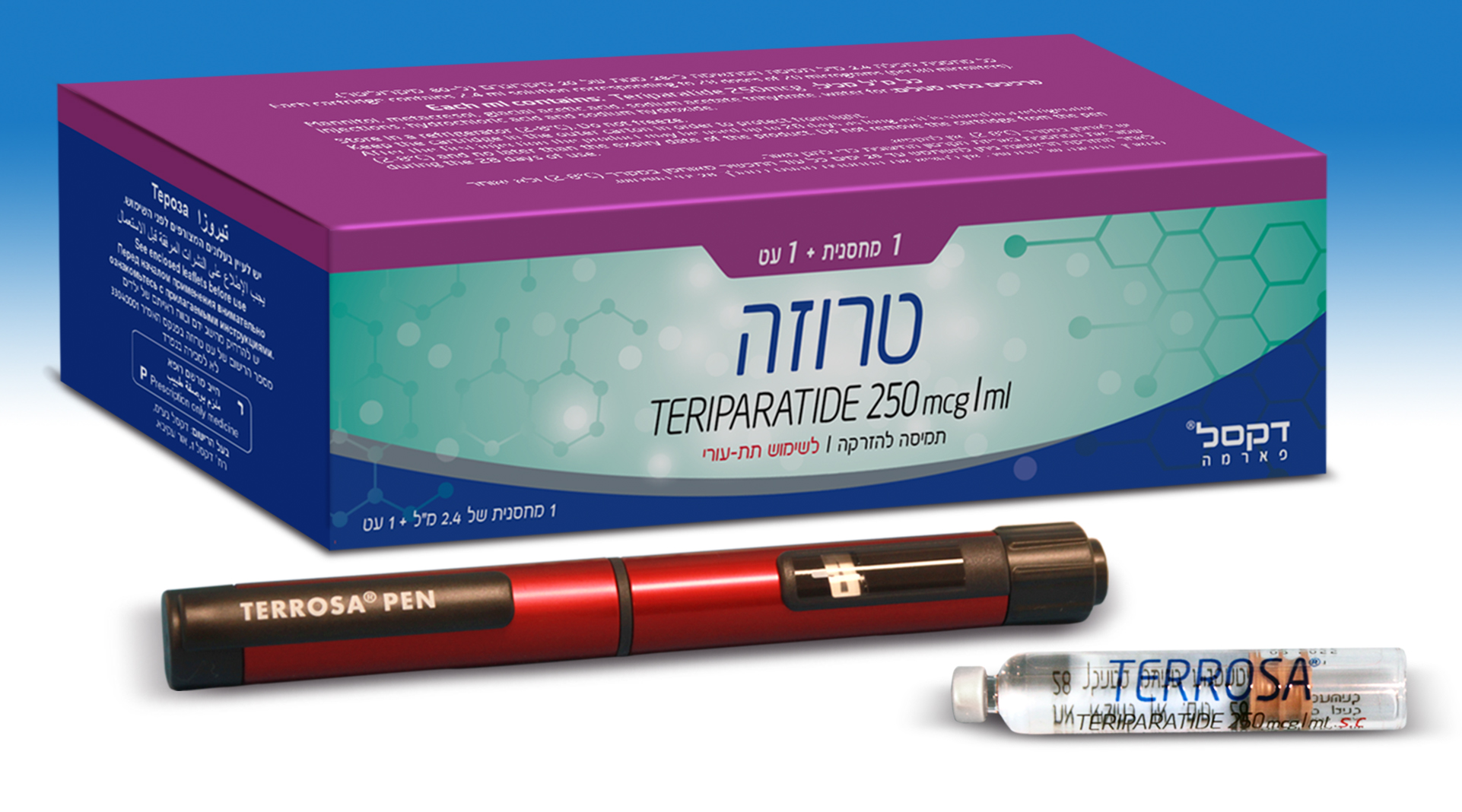
טרוזה TERROSA (TERIPARATIDE)
תרופה במרשם
תרופה בסל
נרקוטיקה
ציטוטוקסיקה
צורת מתן:
תת-עורי : S.C
צורת מינון:
תמיסה להזרקה : SOLUTION FOR INJECTION
עלון לרופא
מינוניםPosology התוויות
Indications תופעות לוואי
Adverse reactions התוויות נגד
Contraindications אינטראקציות
Interactions מינון יתר
Overdose הריון/הנקה
Pregnancy & Lactation אוכלוסיות מיוחדות
Special populations תכונות פרמקולוגיות
Pharmacological properties מידע רוקחי
Pharmaceutical particulars אזהרת שימוש
Special Warning עלון לרופא
Physicians Leaflet
Adverse reactions : תופעות לוואי
6 ADVERSE REACTIONS 6.1 Clinical Trials Experience Because clinical studies are conducted under widely varying conditions, adverse reaction rates observed in the clinical studies of a drug cannot be directly compared to rates in the clinical studies of another drug and may not reflect the rates observed in practice. Men with Primary or Hypogonadal Osteoporosis and Postmenopausal Women with Osteoporosis The safety of teriparatide in the treatment of osteoporosis in men and postmenopausal women was assessed in two randomized, double-blind, placebo-controlled trials of 1,382 patients (21% men, 79% women) aged 28 to 86 years (mean 67 years) [see Clinical Studies (13.1, 13.2)]. The median durations of the trials were 11 months for men and 19 months for women, with 691 patients exposed to teriparatide and 691 patients to placebo. All patients received 1,000 mg of calcium plus at least 400 IU of vitamin D supplementation per day. The incidence of all-cause mortality was 1% in the teriparatide group and 1% in the placebo group. The incidence of serious adverse events was 16% in the teriparatide group and 19% in the placebo group. Early discontinuation due to adverse events occurred in 7% in the teriparatide group and 6% in the placebo group. Table 1 lists adverse events from these two trials that occurred in ≥2% of teriparatide-treated and more frequently than placebo-treated patients. Table 1: Percentage of Patients with Adverse Events Reported by at Least 2% of Teriparatide-Treated Patients and in More Teriparatide-Treated Patients than Placebo-Treated Patients from the Two Principal Osteoporosis Trials in Women and Men Adverse Events are Shown Without Attribution of Causality Teriparatide Placebo N=691 N=691 Event Classification (%) (%) Body as a Whole Pain 21.3 20.5 Headache 7.5 7.4 Asthenia 8.7 6.8 Neck pain 3.0 2.7 Cardiovascular Hypertension 7.1 6.8 Angina pectoris 2.5 1.6 Syncope 2.6 1.4 Digestive System Nausea 8.5 6.7 Constipation 5.4 4.5 Diarrhea 5.1 4.6 Dyspepsia 5.2 4.1 Vomiting 3.0 2.3 Gastrointestinal disorder 2.3 2.0 Tooth disorder 2.0 1.3 Musculoskeletal Arthralgia 10.1 8.4 Leg cramps 2.6 1.3 Nervous System Dizziness 8.0 5.4 Depression 4.1 2.7 Insomnia 4.3 3.6 Vertigo 3.8 2.7 Respiratory System Rhinitis 9.6 8.8 Cough increased 6.4 5.5 Pharyngitis 5.5 4.8 Dyspnea 3.6 2.6 Pneumonia 3.9 3.3 Skin and Appendages Rash 4.9 4.5 Sweating 2.2 1.7 Laboratory Findings Serum Calcium — Teriparatide transiently increased serum calcium, with the maximal effect observed at approximately 4 to 6 hours post-dose. Serum calcium measured at least 16 hours post-dose was not different from pretreatment levels. In clinical trials, the frequency of at least 1 episode of transient hypercalcemia in the 4 to 6 hours after teriparatide administration was 11% of women and 6% of men treated with teriparatide compared to 2% of women and 0% of the men treated with placebo. The percentage of patients treated with teriparatide whose transient hypercalcemia was verified on consecutive measurements was 3% of women and 1% of men. Urinary Calcium — Teriparatide increased urinary calcium excretion, but the frequency of hypercalciuria in clinical trials was similar for patients treated with teriparatide and placebo [see Clinical Pharmacology (11.2)]. Serum Uric Acid — Teriparatide increased serum uric acid concentrations. In clinical trials, 3% of teriparatide-treated patients had serum uric acid concentrations above the upper limit of normal compared with 1% of placebo-treated patients. However, the hyperuricemia did not result in an increase in gout, arthralgia or urolithiasis. Renal Function — No clinically important adverse renal effects were observed in clinical studies. Assessments included creatinine clearance; measurements of blood urea nitrogen (BUN), creatinine, and electrolytes in serum; urine specific gravity and pH; and examination of urine sediment. Men and Women with Glucocorticoid-Induced Osteoporosis The safety of teriparatide in the treatment of men and women with glucocorticoid-induced osteoporosis was assessed in a randomized, double-blind, active-controlled trial of 428 patients (19% men, 81% women) aged 22 to 89 years (mean 57 years) treated with ≥ 5mg per day prednisone or equivalent for a minimum of 3 months [see Clinical Studies (13.3)]. The duration of the trial was 18 months with 214 patients exposed to teriparatide and 214 patients exposed to an oral daily bisphosphonate (active control). All patients received 1,000 mg of calcium plus 800 IU of vitamin D supplementation per day. There was no increase in mortality in the teriparatide group compared to the active control group. The incidence of serious adverse events was 21% in teriparatide patients and 18% in active control patients, and included pneumonia (3% teriparatide, 1% active control). Early discontinuation because of adverse events occurred in 15% of teriparatide patients and 12% of active control patients, and included dizziness (2% teriparatide, 0% active control). Adverse events reported at a higher incidence in the teriparatide group and with at least a 2% difference in teriparatide-treated patients compared with active control-treated patients were: nausea (14%, 7%), gastritis (7%, 3%), pneumonia (6%, 3%), dyspnea (6%, 3%), insomnia (5%, 1%), anxiety (4%, 1%), and herpes zoster (3%, 1%), respectively. 6.2 Immunogenicity As with all peptides, there is potential for immunogenicity. The detection of antibody formation is highly dependent on the sensitivity and specificity of the assay. Additionally, the observed incidence of antibody (including neutralizing antibody) positivity in an assay may be influenced by several factors, including assay methodology, sample handling, timing of sample collection, concomitant medications, and underlying disease. For these reasons, comparison of the incidence of antibodies in the studies described below with the incidence of antibodies in other studies or to other teriparatide products may be misleading. In the clinical trial of postmenopausal women with osteoporosis [see Clinical Studies (13.1)], antibodies that cross-reacted with teriparatide were detected in 3% of women (15/541) who received teriparatide. Generally, antibodies were first detected following 12 months of treatment and diminished after withdrawal of therapy. There was no evidence of hypersensitivity reactions among these patients. Antibody formation did not appear to have effects on serum calcium, or on bone mineral density (BMD) response. 6.3 Postmarketing Experience Adverse Reactions from Postmarketing Spontaneous Reports The following adverse reactions have been identified during postapproval use of teriparatide. Because these reactions are reported voluntarily from a population of uncertain size, it is not always possible to reliably estimate their frequency or establish a causal relationship to drug exposure. • Cases of bone tumor and osteosarcoma have been reported rarely in the postmarketing period [see Warnings and Precautions (5.1)]. • Hypercalcemia greater than 13 mg/dL has been reported with teriparatide use. Adverse events reported since market introduction that were temporally related to teriparatide therapy include the following: • Allergic Reactions: Anaphylactic reactions, drug hypersensitivity, angioedema, urticaria • Investigations: Hyperuricemia • Respiratory System: Acute dyspnea, chest pain • Musculoskeletal: Muscle spasms of the leg or back • Other: Injection site reactions including injection site pain, swelling and bruising; oro-facial edema Adverse Reactions from Observational Studies to Assess Incidence of Osteosarcoma Two osteosarcoma surveillance safety studies (U.S. claims-based database studies) were designed to obtain data on the incidence rate of osteosarcoma among teriparatide-treated patients. In these two studies, three and zero osteosarcoma cases were identified among 379,283 and 153,316 teriparatide users, respectively. The study results suggest a similar risk for osteosarcoma between teriparatide users and their comparators. However, the interpretation of the study results calls for caution owing to the limitations of the data sources which do not allow for complete measurement and control for confounders. Reporting of suspected adverse reactions Reporting suspected adverse reactions after authorization of the medicinal product is important. It allows continued monitoring of the benefit/risk balance of the medicinal product. Any suspected adverse events should be reported to the Ministry of Health according to the National Regulation by using an online form https://sideeffects.health.gov.il.

פרטי מסגרת הכללה בסל
התרופה תינתן לטיפול בהתקיים אחד מאלה: א. חולים עם אוסטיאופורוזיס קשה (t score נמוך מ-3.5-) או שבר אוסטיאופורוטי (שבר באזור אופייני בשלד שלא נגרם מחבלה קשה) אשר אינם מסוגלים לקבל טיפול אחר (ביספוספונאטים במתן פומי או תוך ורידי או רלוקסיפן) עקב הוראות נגד או תופעות לוואי; ב. קו טיפול ראשון בחולים עם אוסטאופורוזיס אידיופתי או מטופלות פוסטמנפאוזליות המצויים בסיכון גבוה מאוד לשבר, אשר עברו שבר אחד לפחות בשנתיים האחרונות עם צפיפות עצם נמוכה מ-2.5- (t score).ג. חולי אוסטיאופורוזיס שבמהלך טיפולים אחרים (כולל ביספוספונאטים במתן פומי או תוך ורידי או רלוקסיפן) חלה הידרדרות משמעותית במצבם*, המוגדרת כאחד מאלה: 1. שבר אוסטיאופורוטי. 2. הרעה מובהקת במדידות חוזרות של צפיפות העצם, מעבר לטעות המדידה (ירידה, הכוללת את טעות המדידה של המכשיר, של לפחות 5%, בעמוד השדרה או בירך (total hip)) לאחר שנתיים של מיצוי הטיפולים הקיימים. הערה: לאור ההסתייגות של האגודה הישראלית לאנדוקרינולוגיה, יש לעשות שימוש במדד זה באופן זהיר ומושכל.האמור בפסקאות משנה (א) ו-(ב) כפוף לשלילת סיבות נוספות לכישלון הטיפולי כגון חסר בויטמין D, עודף ב-PTH וכיו"ב. במהלך מחלתו חולה יהיה זכאי לקבל טיפול באחת מהתרופות – Romosozumab, Teriparatide*הערה: יש להדגיש כי עפ"י המלצות האגודה הישראלית לאנדוקרינולוגיה: -הגדרת הידרדרות משמעותית במצב החולה הינה רק לאחר שנה ומעלה של טיפולים בביספוספונאטים במתן פומי או תוך ורידי או רלוקסיפן. -הופעת שבר בעת הטיפול ברלוקסיפן אינו מהווה התוויה מיידית למתן Teriparatide וניתן לעבור קודם לטיפול בביספוספונאט תוך ורידי, ורק אם תחול התדרדרות תוך טיפול זה, לעבור לטיפול ב-Teriparatide.ד. טיפול באוסטיאופורוזיס על רקע שימוש בגלוקוקורטיקואידים סיסטמיים בחולים המצויים בסיכון מוגבר להתפתחות שבר העונים על כל אלה:1. מטופלים בסטרואידים במינון תואם לפרדניזון 7.5 מ"ג ומעלה ליום למשך 3 חודשי טיפול ומעלה 2. עונים על אחד מאלה:א. בעלי צפיפות עצם נמוכה ( T score≤ -2.5); ב. חוו שבר אוסטיאופורוטי.
מסגרת הכללה בסל
התוויות הכלולות במסגרת הסל
| התוויה | תאריך הכללה | תחום קליני | Class Effect | מצב מחלה |
|---|---|---|---|---|
| קו טיפול ראשון בחולים עם אוסטאופורוזיס אידיופתי או מטופלות פוסטמנפאוזליות המצויים בסיכון גבוה מאוד לשבר, אשר עברו שבר אחד לפחות בשנתיים האחרונות עם צפיפות עצם נמוכה מ-2.5- (t score). | 03/02/2022 | אנדוקרינולוגיה | ||
| טיפול באוסטיאופורוזיס על רקע שימוש בגלוקוקורטיקואידים סיסטמיים בחולים המצויים בסיכון מוגבר להתפתחות שבר העונים על כל אלה: 1. מטופלים בסטרואידים במינון תואם לפרדניזון 7.5 מ"ג ומעלה ליום למשך 3 חודשי טיפול ומעלה 2. עונים על אחד מאלה: א. בעלי צפיפות עצם נמוכה ( T score≤ -2.5); ב. חוו שבר אוסטיאופורוטי. | 30/01/2020 | אנדוקרינולוגיה | ||
| חולי אוסטיאופורוזיס שבמהלך טיפולים אחרים (כולל ביספוספונאטים במתן פומי או תוך ורידי או רלוקסיפן) חלה הידרדרות משמעותית במצבם*, המוגדרת כאחד מאלה: 1. שבר אוסטיאופורוטי. 2. הרעה מובהקת במדידות חוזרות של צפיפות העצם, מעבר לטעות המדידה (ירידה, הכוללת את טעות המדידה של המכשיר, של לפחות 5%, בעמוד השדרה או בירך (total hip)) לאחר שנתיים של מיצוי הטיפולים הקיימים | 01/03/2008 | אנדוקרינולוגיה | ||
| חולים עם אוסטיאופורוזיס קשה (t score נמוך מ-3.5-) או שבר אוסטיאופורוטי (שבר באזור אופייני בשלד שלא נגרם מחבלה קשה) אשר אינם מסוגלים לקבל טיפול אחר (ביספוספונאטים במתן פומי או תוך ורידי או רלוקסיפן) עקב הוראות נגד או תופעות לוואי; | 01/03/2008 | אנדוקרינולוגיה |
שימוש לפי פנקס קופ''ח כללית 1994
לא צוין
תאריך הכללה מקורי בסל
01/03/2008
הגבלות
תרופה מוגבלת לרישום ע'י רופא מומחה או הגבלה אחרת
מידע נוסף
