Quest for the right Drug
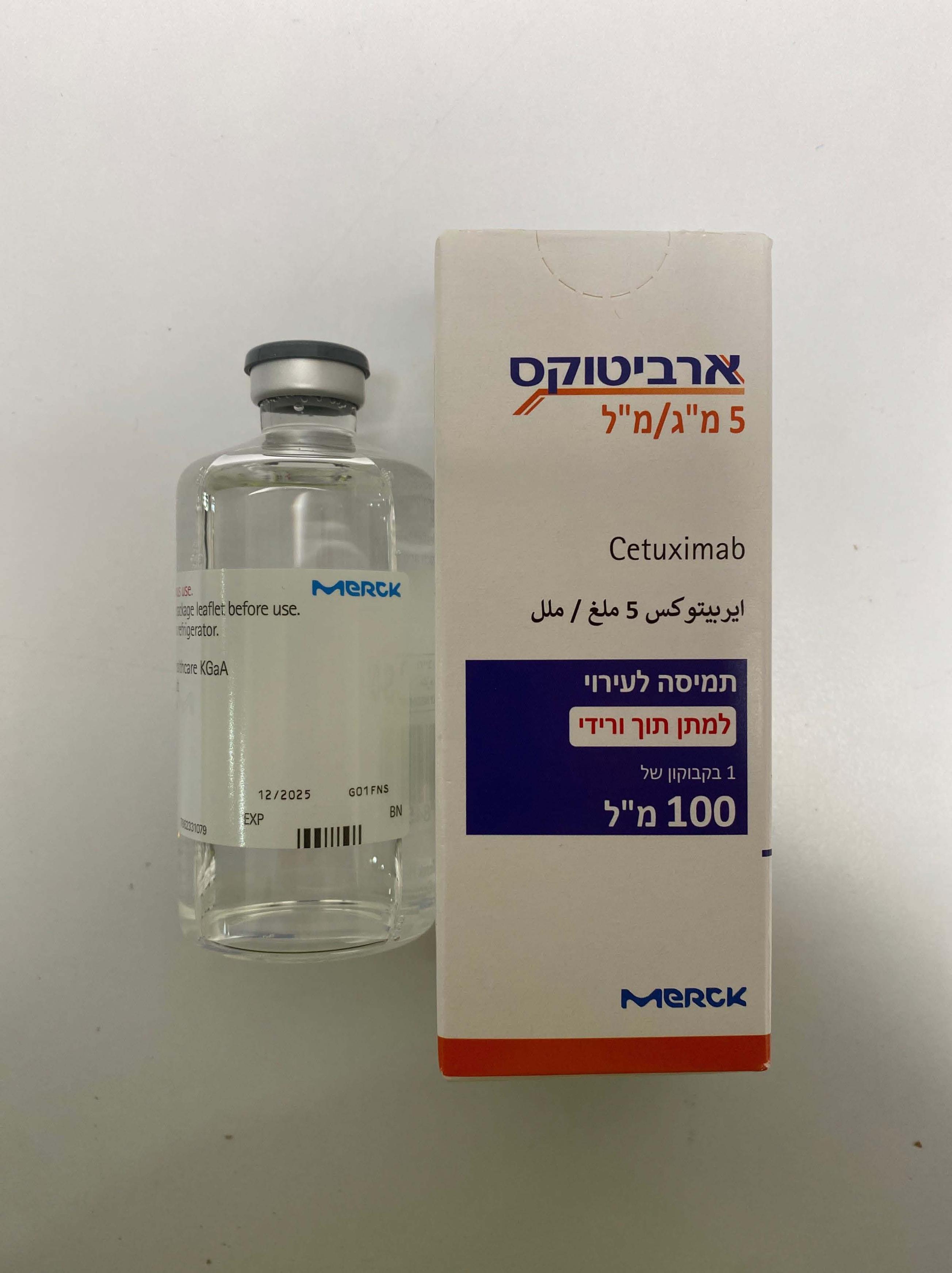
ארביטוקס 5 מ"ג/מ"ל ERBITUX 5 MG/ML (CETUXIMAB)
תרופה במרשם
תרופה בסל
נרקוטיקה
ציטוטוקסיקה
צורת מתן:
תוך-ורידי : I.V
צורת מינון:
תמיסה לאינפוזיה : SOLUTION FOR INFUSION
עלון לרופא
מינוניםPosology התוויות
Indications תופעות לוואי
Adverse reactions התוויות נגד
Contraindications אינטראקציות
Interactions מינון יתר
Overdose הריון/הנקה
Pregnancy & Lactation אוכלוסיות מיוחדות
Special populations תכונות פרמקולוגיות
Pharmacological properties מידע רוקחי
Pharmaceutical particulars אזהרת שימוש
Special Warning עלון לרופא
Physicians Leaflet
Pharmaceutical particulars : מידע רוקחי
6. PHARMACEUTICAL PARTICULARS 6.1. List of excipients Sodium chloride Glycine Polysorbate 80 Citric acid monohydrate Sodium hydroxide Water for injections 6.2. Incompatibilities This medicinal product must not be mixed with other medicinal products except those mentioned in section 6.6. 6.3. Shelf life The expiry date of the medicine is indicated on the label and package. Chemical and physical in-use stability of Erbitux 5 mg/mL has been demonstrated for 48 hours at 25ºC, if the solution is prepared as described in section 6.6. Erbitux does not contain any antimicrobial preservative or bacteriostatic agent. From a microbiological point of view, the product shall be used immediately after opening. If not used immediately, in-use storage times and conditions prior to use are the responsibility of the user and would normally not be longer than 24 hours at 2 to 8ºC, unless opening has taken place in controlled and validated aseptic conditions. 6.4. Special precautions for storage Store in a refrigerator (2°C – 8°C). For storage conditions after opening, see section 6.3. 6.5. Nature and contents of container 20 mL or 100 mL of solution in a vial (Type I glass) with a stopper (halobutyl rubber) and a seal (aluminium/polypropylen). Pack size of 1 vial. Not all vial sizes may be marketed. 6.6. Special precautions for disposal and other handling Erbitux may be administered via a gravity drip, an infusion pump or a syringe pump. A separate infusion line must be used for the infusion, and the line must be flushed with sterile sodium chloride 9 mg/mL (0.9%) solution for injection at the end of infusion. Erbitux 5 mg/mL is compatible • with polyethylene (PE), ethyl vinyl acetate (EVA) or polyvinyl chloride (PVC) bags, • with polyethylene (PE), polyurethane (PUR), ethyl vinyl acetate (EVA), polyolefine thermoplastic (TP) or polyvinyl chloride (PVC) infusion sets, • with polypropylene (PP) syringes for syringe pump. Care must be taken to ensure aseptic handling when preparing the infusion. Erbitux 5 mg/mL must be prepared as follows: • For administration with infusion pump or gravity drip (diluted with sterile sodium chloride 9 mg/mL (0.9%) solution): Take an infusion bag of adequate size of sterile sodium chloride 9 mg/mL (0.9%) solution. Calculate the required volume of Erbitux. Remove an adequate volume of the sodium chloride solution from the infusion bag, using an appropriate sterile syringe with a suitable needle. Take an appropriate sterile syringe and attach a suitable needle. Draw up the required volume of Erbitux from a vial. Transfer the Erbitux into the prepared infusion bag. Repeat this procedure until the calculated volume has been reached. Connect the infusion line and prime it with the diluted Erbitux before starting the infusion. Use a gravity drip or an infusion pump for administration. Set and control the rate as explained in section 4.2. • For administration with infusion pump or gravity drip (undiluted): Calculate the required volume of Erbitux. Take an appropriate sterile syringe (minimum 50 mL) and attach a suitable needle. Draw up the required volume of Erbitux from a vial. Transfer the Erbitux into a sterile evacuated container or bag. Repeat this procedure until the calculated volume has been reached. Connect the infusion line and prime it with Erbitux before starting the infusion. Set and control the rate as explained in section 4.2. • For administration with a syringe pump: Calculate the required volume of Erbitux. Take an appropriate sterile syringe and attach a suitable needle. Draw up the required volume of Erbitux from a vial. Remove the needle and put the syringe into the syringe pump. Connect the infusion line to the syringe, set and control the rate as explained in section 4.2 and start the infusion after priming the line with Erbitux or sterile sodium chloride 9 mg/mL (0.9%) solution. If necessary, repeat this procedure until the calculated volume has been infused. 7. REGISTRATIION LICENSE NUMBER 141-40-31828-00

פרטי מסגרת הכללה בסל
1. התרופה תינתן לטיפול במקרים האלה: א. בשילוב עם הקרנות לטיפול בסרטן ראש צוואר מתקדם מקומי מסוג תאים קשקשיים (Squamous cell carcinoma of the head and neck - SCCHN). ב. בשילוב עם כימותרפיה או כתכשיר יחיד לטיפול בסרטן גרורתי ו/או חוזר של הראש והצוואר מסוג תאים קשקשיים (SCCHN - Squamous cell carcinoma of the head and neck). ג. בשילוב עם כימותרפיה לטיפול בסרטן מעי גס גרורתי כקו טיפול ראשון או כקו טיפול מתקדם (שני והלאה), עבור חולים עם גידולים בלא מוטציה ב-KRAS. 2. קיבל החולה טיפול באחת מהתרופות Cetuximab או Panitumumab, לא יקבל טיפול בתרופה האחרת, למחלה זו. 3. הטיפול בתכשיר יינתן לחולה שטרם טופל ב-CETUXIMAB למחלה זו.4. מתן התרופה ייעשה לפי מרשם של מומחה באונקולוגיה.
מסגרת הכללה בסל
התוויות הכלולות במסגרת הסל
| התוויה | תאריך הכללה | תחום קליני | Class Effect | מצב מחלה |
|---|---|---|---|---|
| בשילוב עם כימותרפיה לטיפול בסרטן מעי גס גרורתי כקו טיפול ראשון או כקו טיפול מתקדם (שני והלאה), עבור חולים עם גידולים בלא מוטציה ב-KRAS. | 20/09/2006 | |||
| בשילוב עם כימותרפיה או כתכשיר יחיד לטיפול בסרטן גרורתי ו/או חוזר של הראש והצוואר מסוג תאים קשקשיים (SCCHN - Squamous cell carcinoma of the head and neck). | 20/09/2006 | |||
| בשילוב עם הקרנות לטיפול בסרטן ראש צוואר מתקדם מקומי מסוג תאים קשקשיים (Squamous cell carcinoma of the head and neck - SCCHN). | 20/09/2006 |
שימוש לפי פנקס קופ''ח כללית 1994
לא צוין
תאריך הכללה מקורי בסל
20/09/2006
הגבלות
תרופה מוגבלת לרישום ע'י רופא מומחה או הגבלה אחרת
מידע נוסף
