Quest for the right Drug
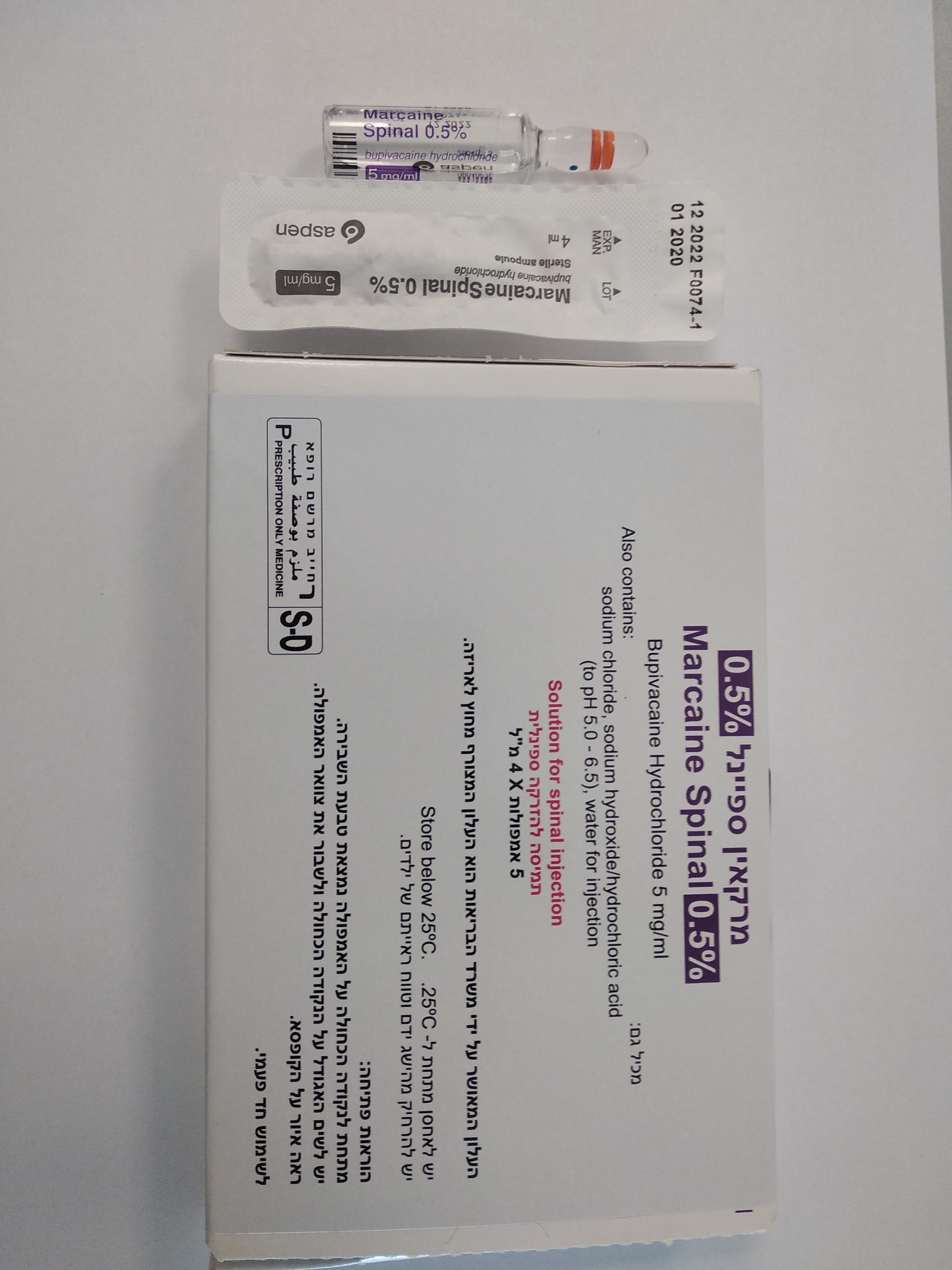
מרקאין ספיינל % 0.5 MARCAINE SPINAL 0.5 % (BUPIVACAINE HYDROCHLORIDE)
תרופה במרשם
תרופה בסל
נרקוטיקה
ציטוטוקסיקה
צורת מתן:
שדרתי : SPINAL
צורת מינון:
תמיסה להזרקה : SOLUTION FOR INJECTION
עלון לרופא
מינוניםPosology התוויות
Indications תופעות לוואי
Adverse reactions התוויות נגד
Contraindications אינטראקציות
Interactions מינון יתר
Overdose הריון/הנקה
Pregnancy & Lactation אוכלוסיות מיוחדות
Special populations תכונות פרמקולוגיות
Pharmacological properties מידע רוקחי
Pharmaceutical particulars אזהרת שימוש
Special Warning עלון לרופא
Physicians Leaflet
Adverse reactions : תופעות לוואי
4.8 Undesirable effects Undesirable effects caused by the medicinal product itself may be difficult to distinguish from the physiological effects of nerve blockade (e.g. hypotension, bradycardia, transient urinary retention), cases caused directly by the needle stick (e.g. spinal hematoma ) or caused indirectly by the needle stick (e.g. meningitis, epidural abscess) or cases associated with cerebrospinal leakage (e.g. postdural puncture headache). For information on the symptoms and treatment of acute systemic toxicity, refer to section 4.9 Overdose. Very common General disorders: Nausea (>1/10) Circulation disorders: Hypotension, bradycardia Common Nervous system disorders: Postdural puncture headache (>1/100) Gastrointestinal disorders: Vomiting Renal and urinary disorders: Urinary retention, urinary incontinence Uncommon Nervous system disorders: Paraesthesia, paresis, dysesthesia Musculoskeletal and connective tissue disorders: Muscle weakness, back pain Rare (<1/1000) Circulation disorders: Cardiac arrest General disorders: Allergic reactions, anaphylactic shock Nervous system disorders: Involuntary total spinal blockade, paraplegia, paralysis, neuropathy, arachnoiditis Respiratory, thoracic and mediastinal disorders: Respiratory depression Reporting of suspected adverse reactions Reporting suspected adverse reactions after authorisation of the medicinal product is important. It allows continued monitoring of the benefit/risk balance of the medicinal product. Any suspected adverse events should be reported to the Ministry of Health according to the National Regulation by using an online form https://sideeffects.health.gov.il Additionally, you can report to Padagis via the following address: Padagis.co.il

שימוש לפי פנקס קופ''ח כללית 1994
לא צוין
תאריך הכללה מקורי בסל
01/01/1995
הגבלות
תרופה שאושרה לשימוש כללי בקופ'ח
מידע נוסף
