Quest for the right Drug
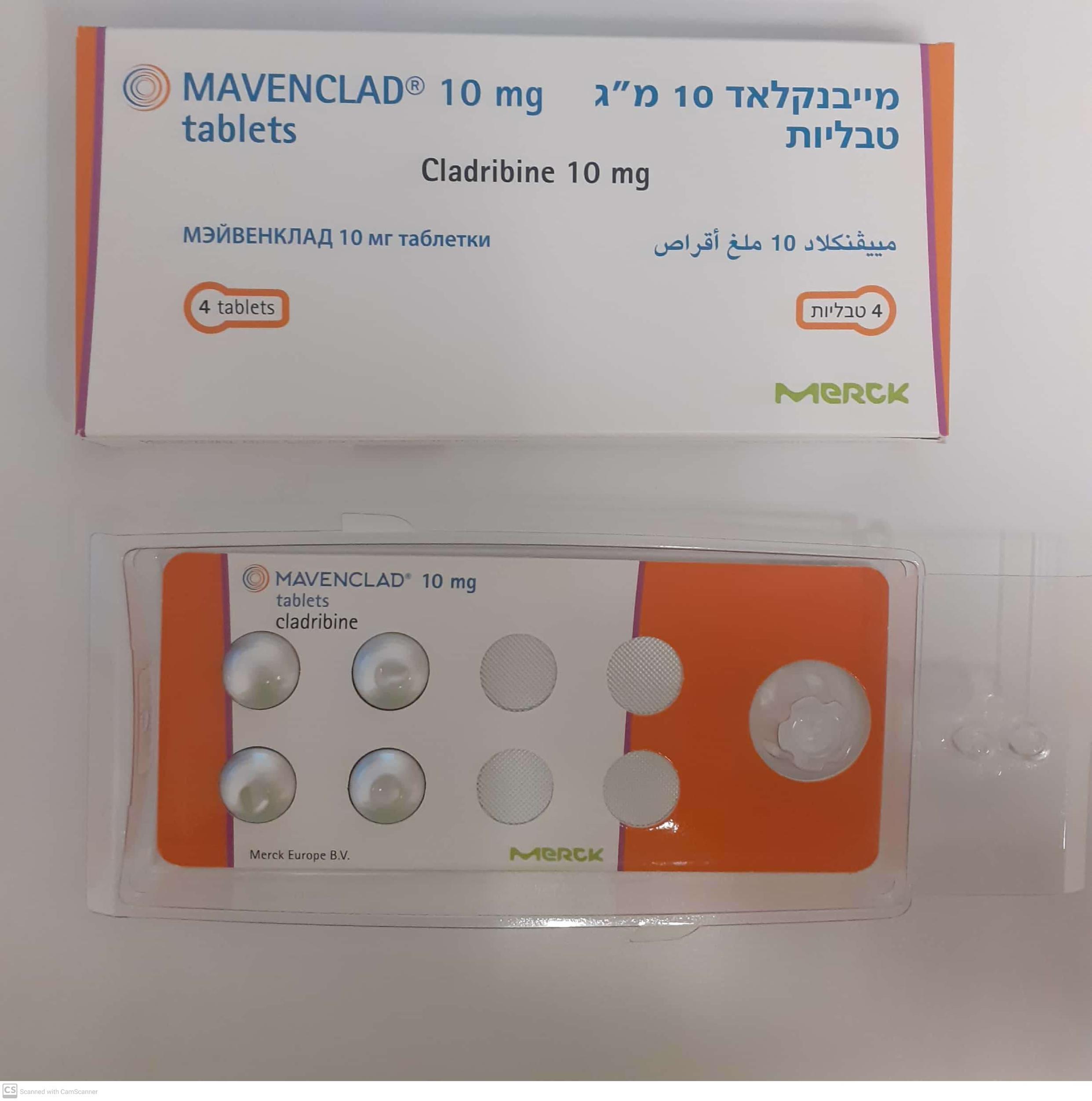
מייבנקלאד 10 מ"ג טבליות MAVENCLAD 10 MG TABLETS (CLADRIBINE)
תרופה במרשם
תרופה בסל
נרקוטיקה
ציטוטוקסיקה
צורת מתן:
פומי : PER OS
צורת מינון:
טבליה : TABLETS
עלון לרופא
מינוניםPosology התוויות
Indications תופעות לוואי
Adverse reactions התוויות נגד
Contraindications אינטראקציות
Interactions מינון יתר
Overdose הריון/הנקה
Pregnancy & Lactation אוכלוסיות מיוחדות
Special populations תכונות פרמקולוגיות
Pharmacological properties מידע רוקחי
Pharmaceutical particulars אזהרת שימוש
Special Warning עלון לרופא
Physicians Leaflet
Posology : מינונים
4.2 Posology and method of administration Treatment must be initiated and supervised by a physician experienced in the treatment of MS. Posology The recommended cumulative dose is 3.5 mg/kg body weight over 2 years, administered as 1 treatment course of 1.75 mg/kg per year. Each treatment course consists of 2 treatment weeks, one at the beginning of the first month and one at the beginning of the second month of the respective treatment year. If medically necessary (e.g. for recovery of lymphocytes), the treatment course in year 2 can be delayed for up to 6 months. Each treatment week consists of 4 or 5 days on which a patient receives 10 mg or 20 mg (one or two tablets) as a single daily dose, depending on body weight. For details, see Tables 1 and 2 below. Following completion of the 2 treatment courses, no further cladribine treatment is required in years 3 and 4 (see section 5.1). Re-initiation of therapy after year 4 has not been studied. Criteria for initiating and continuing therapy Lymphocyte counts must be • normal before initiating treatment in year 1, • at least 800 cells/mm³ before initiating treatment in year 2. If necessary, the treatment course in year 2 can be delayed for up to 6 months to allow for recovery of lymphocytes. If this recovery takes more than 6 months, the patient should not receive cladribine tablets anymore. Distribution of dose The distribution of the total dose over the 2 years of treatment is provided in Table 1. For some weight ranges the number of tablets may vary from one treatment week to the next. Use of oral cladribine in patients weighing less than 40 kg has not been investigated. Table 1 Dose of cladribine per treatment week by patient weight in each treatment year Weight range Dose in mg (number of tablets) per treatment week kg Treatment week 1 Treatment week 2 40 to <50 40 mg (4 tablets) 40 mg (4 tablets) 50 to <60 50 mg (5 tablets) 50 mg (5 tablets) 60 to <70 60 mg (6 tablets) 60 mg (6 tablets) 70 to <80 70 mg (7 tablets) 70 mg (7 tablets) 80 to <90 80 mg (8 tablets) 70 mg (7 tablets) 90 to <100 90 mg (9 tablets) 80 mg (8 tablets) 100 to <110 100 mg (10 tablets) 90 mg (9 tablets) 110 and above 100 mg (10 tablets) 100 mg (10 tablets) Table 2 shows how the total number of tablets per treatment week is distributed over the individual days. It is recommended that the daily cladribine doses in each treatment week be taken at intervals of 24 hours at approximately the same time each day. If a daily dose consists of two tablets, both tablets are taken together as a single dose. Table 2 Number of tablets per week day Total number of tablets per week Day 1 Day 2 Day 3 Day 4 Day 5 4 1 1 1 1 0 5 1 1 1 1 1 6 2 1 1 1 1 7 2 2 1 1 1 8 2 2 2 1 1 9 2 2 2 2 1 10 2 2 2 2 2 A missed dose must be taken as soon as remembered on the same day according to the treatment schedule. A missed dose must not be taken together with the next scheduled dose on the following day. In the case of a missed dose, the patient must take the missed dose on the following day, and extend the number of days in that treatment week. If two consecutive doses are missed, the same rule applies, and the number of days in the treatment week is extended by two days. Concomitant use of other oral medicinal products It is recommended that administration of any other oral medicinal product be separated from that of MAVENCLAD by at least 3 hours during the limited number of days of cladribine administration (see section 4.5). Special populations Renal impairment No dedicated studies have been conducted in patients with renal impairment. In patients with mild renal impairment (creatinine clearance 60 to 89 mL/min), no dose adjustment is considered necessary (see section 5.2). Safety and efficacy in patients with moderate or severe renal impairment have not been established. Therefore, cladribine is contraindicated in these patients (see section 4.3). Hepatic impairment No studies have been conducted in patients with hepatic impairment. No dose adjustment is required in patients with mild hepatic impairment because the importance of hepatic function for the elimination of cladribine is considered negligible (see section 5.2). In absence of data, the use of cladribine is not recommended in patients with moderate or severe hepatic impairment (Child-Pugh score >6). Elderly Caution is recommended when cladribine is used in elderly patients, taking into account the potential greater frequency of decreased hepatic or renal function, concomitant diseases and other medicinal therapies. Paediatric population The safety and efficacy of MAVENCLAD in children below the age of 18 years have not been established. No data are available. Method of administration MAVENCLAD is for oral use. The tablets must be taken with water, and swallowed without chewing. The tablets can be taken independent of food intake. As the tablets are uncoated, they must be swallowed immediately once removed from the blister and not be left exposed on surfaces or handled for any period of time longer than that required for dosing. If a tablet is left on a surface, or if a broken or fragmented tablet is released from the blister, the area must be thoroughly washed. The patient's hands must be dry when handling the tablets and washed thoroughly afterwards.

פרטי מסגרת הכללה בסל
א. התרופה תינתן לטיפול במקרים האלה:1. כמונותרפיה בחולים עם אבחנה וודאית של טרשת נפוצה (על פי הקריטריונים העדכניים על שם McDonald) עם מחלה פעילה כולל מחלה פרוגרסיבית שניונית פעילה (active SPMS) או Clinically Isolated Syndrome (CIS), בהתאם לתנאי הרישום.הטיפול לא יינתן לחולים עם מחלה פרוגרסיבית ראשונית (PPMS) או פרוגרסיבית שניונית פעילה (SPMS) שאינם מטופלים בתרופות ייעודיות לטרשת נפוצה.2. כמונותרפיה, בחולים עם אבחנה וודאית של טרשת נפוצה במהלך פרוגרסיבי שניוני (SPMS) עם היסטוריה של RRMS, שהם עם EDSS בערך 7.5 ומטה ועדות למחלה פעילה (לעניין זה מחלה פעילה תוגדר כאחד מאלה - החמרה בשנה האחרונה, פעילות חדשה המוגדרת לפי נגעים חדשים, הרחבה של נגעים קיימים או נגעים קולטים חומרי ניגוד בשנה האחרונה בהדמיית MRI), והחמרה קלינית מתועדת או התקדמות רציפה בנכות במשך 6 חודשים (שתוגדר לעניין זה כאחד מאלה - התקדמות של מעל לנקודה אחת אצל מטופלים עם EDSS ≤ 5.5, או התקדמות של חצי נקודה אצל מטופלים עם EDSS ≥ 6).ב. הטיפול יינתן כמונותרפיה.ב. התחלת הטיפול בתרופה תיעשה לפי מרשם של נוירו אימונולוג שעבר השתלמות עמיתים, או נוירולוג ילדים שעבר השתלמות עמיתים בטרשת נפוצה, או רופא מומחה בנוירולוגיה העובד במרפאת טרשת נפוצה או מרפאה נוירואימונולוגית ייעודית.
מסגרת הכללה בסל
התוויות הכלולות במסגרת הסל
| התוויה | תאריך הכללה | תחום קליני | Class Effect | מצב מחלה |
|---|---|---|---|---|
| טרשת נפוצה - קו ראשון בחולה המאובחן כסובל מטרשת נפוצה מסוג נסיגה נשנית - בהתאם לקריטריונים | 30/01/2020 | נוירולוגיה | טרשת נפוצה | |
| טרשת נפוצה - בחולים אשר פיתחו תופעות לוואי קשות כתוצאה מטיפול קודם הן ב- Interferon beta והן ב-Glatiramer acetate אשר לדעת הרופא המטפל לא מאפשרות את המשך הטיפול | 11/01/2018 | נוירולוגיה | טרשת נפוצה | |
| טרשת נפוצה - כקו ראשון בחולים עם מחלה סוערת | 11/01/2018 | נוירולוגיה | טרשת נפוצה | |
| טרשת נפוצה - טיפול בצורות התקפיות (relapsing) כקו שני ואילך לאחר כשלון בטיפול קודם | 11/01/2018 | נוירולוגיה | טרשת נפוצה | |
| א. התרופה תינתן לטיפול בחולים עם אבחנה וודאית של טרשת נפוצה (על פי הקריטריונים העדכניים על שם McDonald) עם מחלה פעילה או Clinically Isolated Syndrome (CIS), בהתאם לתנאי הרישום. הטיפול לא יינתן לחולים עם מחלה פרוגרסיבית ראשונית (PPMS) או פרוגרסיבית שניונית פעילה (SPMS) שאינם מטופלים בתרופות ייעודיות לטרשת נפוצה. ב. הטיפול יינתן כמונותרפיה. ג. התחלת הטיפול בתרופה תיעשה לפי מרשם של נוירו אימונולוג שעבר השתלמות עמיתים, או נוירולוג ילדים שעבר השתלמות עמיתים בטרשת נפוצה, או מומחה בנוירולוגיה העובד במרפאת טרשת נפוצה או מרפאה נוירואימונולוגית ייעודית. | 03/02/2022 | נוירולוגיה | טרשת נפוצה | |
| א. התרופה תינתן לטיפול במקרים האלה: 1. כמונותרפיה בחולים עם אבחנה וודאית של טרשת נפוצה (על פי הקריטריונים העדכניים על שם McDonald) עם מחלה פעילה כולל מחלה פרוגרסיבית שניונית פעילה (active SPMS) או Clinically Isolated Syndrome (CIS), בהתאם לתנאי הרישום. הטיפול לא יינתן לחולים עם מחלה פרוגרסיבית ראשונית (PPMS) או פרוגרסיבית שניונית פעילה (SPMS) שאינם מטופלים בתרופות ייעודיות לטרשת נפוצה. 2. כמונותרפיה, בחולים עם אבחנה וודאית של טרשת נפוצה במהלך פרוגרסיבי שניוני (SPMS) עם היסטוריה של RRMS, שהם עם EDSS בערך 7.5 ומטה ועדות למחלה פעילה (לעניין זה מחלה פעילה תוגדר כאחד מאלה - החמרה בשנה האחרונה, פעילות חדשה המוגדרת לפי נגעים חדשים, הרחבה של נגעים קיימים או נגעים קולטים חומרי ניגוד בשנה האחרונה בהדמיית MRI), והחמרה קלינית מתועדת או התקדמות רציפה בנכות במשך 6 חודשים (שתוגדר לעניין זה כאחד מאלה - התקדמות של מעל לנקודה אחת אצל מטופלים עם EDSS ≤ 5.5, או התקדמות של חצי נקודה אצל מטופלים עם EDSS ≥ 6). | 17/03/2024 | נוירולוגיה | טרשת נפוצה | |
| התחלת הטיפול בתרופה תיעשה לפי מרשם של נוירו אימונולוג שעבר השתלמות עמיתים, או נוירולוג ילדים שעבר השתלמות עמיתים בטרשת נפוצה, או רופא מומחה בנוירולוגיה העובד במרפאת טרשת נפוצה או מרפאה נוירואימונולוגית ייעודית. | 17/03/2024 | נוירולוגיה | טרשת נפוצה |
שימוש לפי פנקס קופ''ח כללית 1994
לא צוין
תאריך הכללה מקורי בסל
11/01/2018
הגבלות
תרופה מוגבלת לרישום ע'י רופא מומחה או הגבלה אחרת
מידע נוסף
עלון מידע לצרכן
15.01.18 - עלון לצרכן 15.01.18 - עלון לצרכן 15.01.18 - עלון לצרכן 15.01.18 - עלון לצרכן 15.01.18 - עלון לצרכן 09.08.22 - עלון לצרכן אנגלית 09.08.22 - עלון לצרכן עברית 09.08.22 - עלון לצרכן ערבית 13.12.22 - עלון לצרכן אנגלית 13.12.22 - עלון לצרכן עברית 13.12.22 - עלון לצרכן ערבית 13.12.22 - עלון לצרכן 13.12.22 - עלון לצרכן אנגלית 28.02.24 - עלון לצרכן עברית 21.07.24 - עלון לצרכן אנגלית 21.07.24 - עלון לצרכן עברית 21.07.24 - עלון לצרכן ערבית 21.07.24 - עלון לצרכן 21.07.24 - עלון לצרכן אנגלית 22.08.24 - עלון לצרכן עברית 17.02.22 - החמרה לעלון 14.03.22 - החמרה לעלון 28.02.24 - החמרה לעלון 22.08.24 - החמרה לעלוןלתרופה במאגר משרד הבריאות
מייבנקלאד 10 מ"ג טבליות