Quest for the right Drug
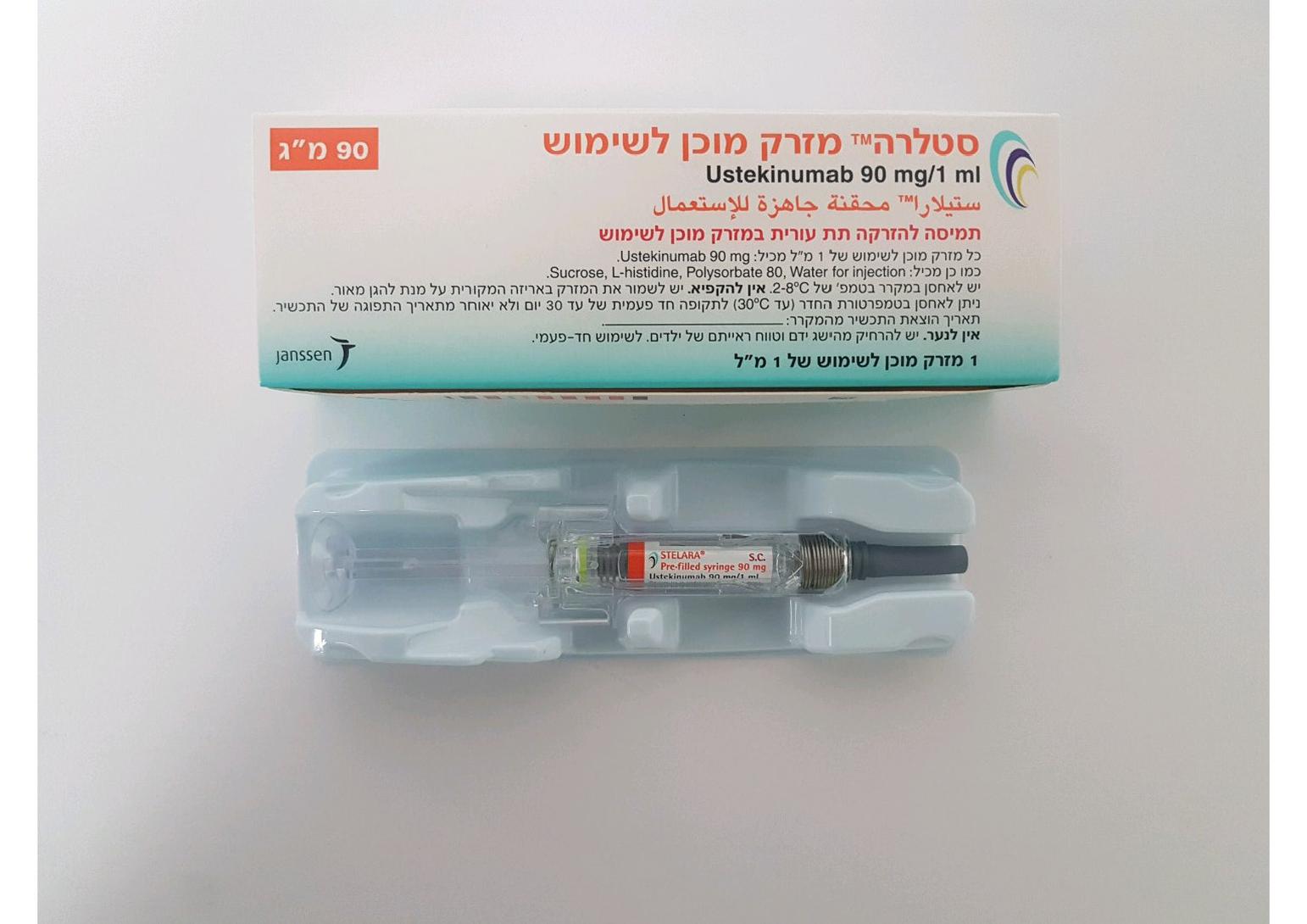
סטלרה מזרק מוכן לשימוש STELARA PREFILLED SYRINGE (USTEKINUMAB)
תרופה במרשם
תרופה בסל
נרקוטיקה
ציטוטוקסיקה
צורת מתן:
תת-עורי : S.C
צורת מינון:
תמיסה להזרקה : SOLUTION FOR INJECTION
עלון לרופא
מינוניםPosology התוויות
Indications תופעות לוואי
Adverse reactions התוויות נגד
Contraindications אינטראקציות
Interactions מינון יתר
Overdose הריון/הנקה
Pregnancy & Lactation אוכלוסיות מיוחדות
Special populations תכונות פרמקולוגיות
Pharmacological properties מידע רוקחי
Pharmaceutical particulars אזהרת שימוש
Special Warning עלון לרופא
Physicians Leaflet
Posology : מינונים
4.2 Posology and method of administration STELARA is intended for use under the guidance and supervision of physicians experienced in the diagnosis and treatment of conditions for which STELARA is indicated. Posology Plaque psoriasis The recommended posology of STELARA is an initial dose of 45 mg administered subcutaneously, followed by a 45 mg dose 4 weeks later, and then every 12 weeks thereafter. Consideration should be given to discontinuing treatment in patients who have shown no response up to 28 weeks of treatment. Patients with body weight > 100 kg For patients with a body weight > 100 kg the initial dose is 90 mg administered subcutaneously, followed by a 90 mg dose 4 weeks later, and then every 12 weeks thereafter. In these patients, 45 mg was also shown to be efficacious. However, 90 mg resulted in greater efficacy. (see section 5.1, Table 4) Psoriatic arthritis (PsA) The recommended posology of STELARA is an initial dose of 45 mg administered subcutaneously, followed by a 45 mg dose 4 weeks later, and then every 12 weeks thereafter. Alternatively, 90 mg may be used in patients with a body weight > 100 kg. Consideration should be given to discontinuing treatment in patients who have shown no response up to 28 weeks of treatment. Elderly (≥ 65 years) No dose adjustment is needed for elderly patients (see section 4.4). Renal and hepatic impairment STELARA has not been studied in these patient populations. No dose recommendations can be made. Paediatric population The safety and efficacy of STELARA in children with psoriasis less than 6 years of age or in children with psoriatic arthritis less than 18 years of age have not yet been established. Paediatric plaque psoriasis (6 years and older) The recommended dose of STELARA based on body weight is shown below (Tables 1 and 2). STELARA should be administered at Weeks 0 and 4, then every 12 weeks thereafter. Table 1 Recommended dose of STELARA for paediatric psoriasis Body weight at the time of dosing Recommended Dose < 60 kg 0.75 mg/kg ≥ 60-≤ 100 kg 45 mg > 100 kg 90 mg To calculate the volume of injection (mL) for patients < 60 kg, use the following formula: body weight (kg) x 0.0083 (mL/kg) or see Table 2. The calculated volume should be rounded to the nearest 0.01 mL and administered using a 1 mL graduated syringe. A 45 mg vial is available for paediatric patients who need to receive less than the full 45 mg dose. Table 2 Injection volumes of STELARA for paediatric psoriasis patients < 60 kg Body weight at time of dosing Dose (mg) Volume of injection (mL) (kg) 15 11.3 0.12 16 12.0 0.13 17 12.8 0.14 18 13.5 0.15 19 14.3 0.16 20 15.0 0.17 21 15.8 0.17 22 16.5 0.18 23 17.3 0.19 24 18.0 0.20 25 18.8 0.21 26 19.5 0.22 27 20.3 0.22 28 21.0 0.23 29 21.8 0.24 30 22.5 0.25 31 23.3 0.26 32 24.0 0.27 33 24.8 0.27 34 25.5 0.28 35 26.3 0.29 36 27.0 0.30 37 27.8 0.31 38 28.5 0.32 39 29.3 0.32 40 30.0 0.33 41 30.8 0.34 42 31.5 0.35 43 32.3 0.36 44 33.0 0.37 45 33.8 0.37 46 34.5 0.38 47 35.3 0.39 48 36.0 0.40 49 36.8 0.41 50 37.5 0.42 51 38.3 0.42 52 39.0 0.43 53 39.8 0.44 54 40.5 0.45 55 41.3 0.46 56 42.0 0.46 57 42.8 0.47 58 43.5 0.48 59 44.3 0.49 Consideration should be given to discontinuing treatment in patients who have shown no response up to 28 weeks of treatment. Crohn’s Disease and Ulcerative Colitis In the treatment regimen, the first dose of STELARA is administered intravenously. For the posology of the intravenous dosing regimen, see section 4.2 of the STELARA 130 mg Concentrate for solution for infusion PI. The first subcutaneous administration of 90 mg STELARA should take place at week 8 after the intravenous dose. After this, dosing every 12 weeks is recommended. Patients who have not shown adequate response at 8 weeks after the first subcutaneous dose, may receive a second subcutaneous dose at this time (see section 5.1). Patients who lose response on dosing every 12 weeks may benefit from an increase in dosing frequency to every 8 weeks (see section 5.1, section 5.2). Patients may subsequently be dosed every 8 weeks or every 12 weeks according to clinical judgment (see section 5.1). Consideration should be given to discontinuing treatment in patients who show no evidence of therapeutic benefit 16 weeks after the IV induction dose or 16 weeks after switching to the 8-weekly maintenance dose. Immunomodulators and/or corticosteroids may be continued during treatment with STELARA. In patients who have responded to treatment with STELARA, corticosteroids may be reduced or discontinued in accordance with standard of care. In Crohn’s disease or Ulcerative Colitis, if therapy is interrupted, resumption of treatment with subcutaneous dosing every 8 weeks is safe and effective. Elderly (≥ 65 years) No dose adjustment is needed for elderly patients (see section 4.4). In ulcerative colitis -The number of patients aged 65 and over is not sufficient to determine whether they response differently from younger patients. Because there is a higher incidence of infections in the elderly population in general, caution should be used in treating the elderly. Renal and hepatic impairment STELARA has not been studied in these patient populations. No dose recommendations can be made. Paediatric population The safety and efficacy of STELARA in treatment of Crohn’s disease or ulcerative colitis in children less than 18 years have not yet been established. No data are available. Method of administration STELARA 45 mg vial or pre-filled syringes are for subcutaneous injection only. If possible, areas of the skin that show psoriasis should be avoided as injection sites. After proper training in subcutaneous injection technique, patients or their caregivers may inject STELARA if a physician determines that it is appropriate. However, the physician should ensure appropriate follow-up of patients. Patients or their caregivers should be instructed to inject the prescribed amount of STELARA according to the directions provided in the package leaflet. Comprehensive instructions for administration are given in the package leaflet. For further instructions on preparation and special precautions for handling, see section 6.6.

פרטי מסגרת הכללה בסל
1. הטיפול בתרופה יינתן לטיפול במקרים האלה:א. פסוריאזיס בהתקיים כל התנאים האלה: 1. החולה סובל מאחד מאלה: א. מחלה מפושטת מעל ל-50% של שטח גוף או PASI מעל 50; ב. נגעים באזורי גוף רגישים - אזורים אלו יכללו פנים, צוואר, קיפולי עור, כפות ידיים, כפות רגליים, אזור הגניטליה והישבן; 2. החולה קיבל שני טיפולים סיסטמיים לפחות בלא שיפור של 50% לפחות ב-PASI לאחר סיום הטיפול בהשוואה לתחילת הטיפול; בהתייחס לחולה העונה על האמור בפסקת משנה (א)(2) - החולה קיבל שני טיפולים סיסטמיים לפחות בלא שיפור משמעותי לאחר סיום הטיפול בהשוואה לתחילת הטיפול; 3. התרופה תינתן על פי מרשם של רופא מומחה בדרמטולוגיה. ב. דלקת מפרקים פסוריאטית פעילה ומתקדמת כאשר התגובה לתכשירים ממשפחת ה-DMARDs איננה מספקת.ג. טיפול במחלת קרוהן בדרגת חומרה בינונית עד קשה בחולה שמיצה טיפול קודם בתרופה אחת לפחות ממשפחת ה-anti TNF או Vedolizumab.
מסגרת הכללה בסל
התוויות הכלולות במסגרת הסל
| התוויה | תאריך הכללה | תחום קליני | Class Effect | מצב מחלה |
|---|---|---|---|---|
| טיפול במחלת קרוהן בדרגת חומרה בינונית עד קשה בחולה שמיצה טיפול קודם בתרופה אחת לפחות ממשפחת ה-anti TNF או Vedolizumab. | 12/01/2017 | גסטרואנטרולוגיה | Crohn's disease | |
| דלקת מפרקים פסוריאטית פעילה ומתקדמת כאשר התגובה לתכשירים ממשפחת ה-DMARDs איננה מספקת | 21/01/2016 | ראומטולוגיה | TOFACITINIB, ADALIMUMAB, USTEKINUMAB, SECUKINUMAB, ABATACEPT, ETANERCEPT, INFLIXIMAB | Psoriatic arthritis |
| פסוריאזיס בהתקיים כל אלה: א. החולה סובל מאחד מאלה: 1. מחלה מפושטת מעל ל-50% של שטח גוף או PASI מעל 50; 2. נגעים באזורי גוף רגישים - אזורים אלו יכללו פנים, צוואר, קיפולי עור, כפות ידיים, כפות רגליים, אזור הגניטליה והישבן. ב. החולה קיבל שני טיפולים סיסטמיים לפחות ללא שיפור של 50% לפחות ב-PASI לאחר סיום הטיפול בהשוואה לתחילת הטיפול. בהתייחס לחולה העונה על פסקה (1)(א)(2) החולה קיבל שני טיפולים סיסטמיים לפחות בלא שיפור משמעותי לאחר סיום הטיפול בהשוואה לתחילת הטיפול; ג. התרופה תינתן על פי מרשם של רופא מומחה בדרמטולוגיה. | 23/01/2011 | עור ומין | ADALIMUMAB, IXEKIZUMAB, CERTOLIZUMAB PEGOL, USTEKINUMAB, SECUKINUMAB, TILDRAKIZUMAB, GUSELKUMAB, ETANERCEPT, INFLIXIMAB | Psoriasis |
שימוש לפי פנקס קופ''ח כללית 1994
לא צוין
תאריך הכללה מקורי בסל
23/01/2011
הגבלות
תרופה מוגבלת לרישום ע'י רופא מומחה או הגבלה אחרת
מידע נוסף
עלון מידע לצרכן
01.01.19 - עלון לצרכן 20.10.21 - עלון לצרכן אנגלית 19.04.22 - עלון לצרכן עברית 20.10.21 - עלון לצרכן ערבית 18.10.22 - עלון לצרכן עברית 28.02.23 - עלון לצרכן אנגלית 06.06.23 - עלון לצרכן עברית 28.02.23 - עלון לצרכן ערבית 28.02.23 - עלון לצרכן ערבית 21.09.23 - עלון לצרכן אנגלית 21.09.23 - עלון לצרכן עברית 21.09.23 - עלון לצרכן ערבית 03.08.24 - עלון לצרכן עברית 05.11.24 - עלון לצרכן עברית 30.12.13 - החמרה לעלון 27.07.14 - החמרה לעלון 31.12.14 - החמרה לעלון 26.02.19 - החמרה לעלון 14.06.20 - החמרה לעלון 28.01.21 - החמרה לעלון 02.09.21 - החמרה לעלון 19.04.22 - החמרה לעלון 18.10.22 - החמרה לעלון 04.04.23 - החמרה לעלון 06.06.23 - החמרה לעלון 06.06.23 - החמרה לעלון 03.08.24 - החמרה לעלון 06.10.24 - החמרה לעלוןלתרופה במאגר משרד הבריאות
סטלרה מזרק מוכן לשימוש