Quest for the right Drug
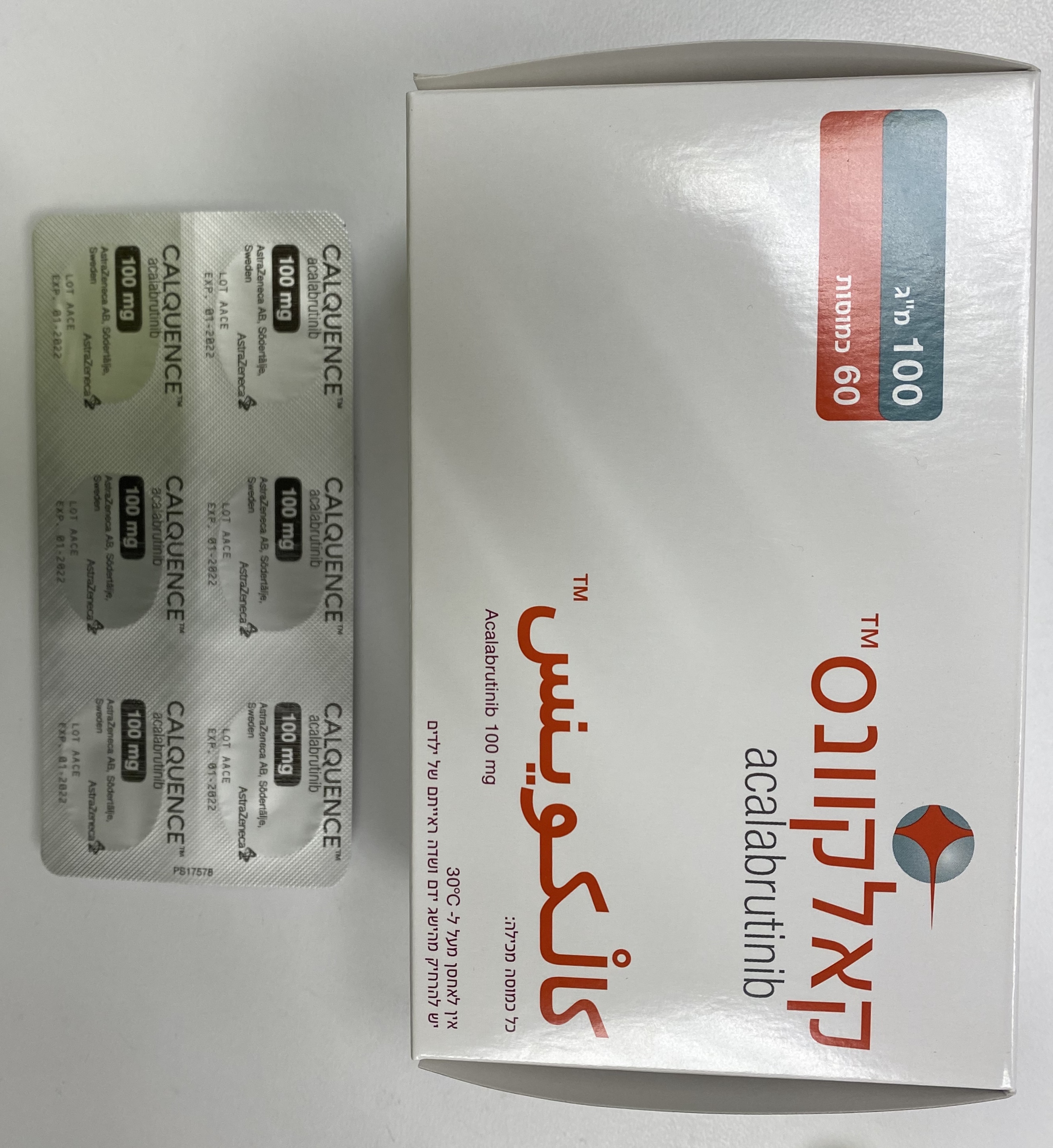
קאלקוונס CALQUENCE (ACALABRUTINIB)
תרופה במרשם
תרופה בסל
נרקוטיקה
ציטוטוקסיקה
צורת מתן:
פומי : PER OS
צורת מינון:
קפסולות : CAPSULES
עלון לרופא
מינוניםPosology התוויות
Indications תופעות לוואי
Adverse reactions התוויות נגד
Contraindications אינטראקציות
Interactions מינון יתר
Overdose הריון/הנקה
Pregnancy & Lactation אוכלוסיות מיוחדות
Special populations תכונות פרמקולוגיות
Pharmacological properties מידע רוקחי
Pharmaceutical particulars אזהרת שימוש
Special Warning עלון לרופא
Physicians Leaflet
Posology : מינונים
5. DOSAGE AND ADMINISTRATION 5.1 Recommended Dosage CALQUENCE CAPSULES as Monotherapy For patients with MCL, CLL, or SLL, the recommended dose of CALQUENCE CAPSULES is 100 mg taken orally approximately every twelve hours until disease progression or unacceptable toxicity. CALQUENCE CAPSULES in Combination with Obinutuzumab For patients with previously untreated CLL or SLL, the recommended dose of CALQUENCE CAPSULES is 100 mg taken orally approximately every 12 hours until disease progression or unacceptable toxicity. Start CALQUENCE CAPSULES at Cycle 1 (each cycle is 28 days). Start obinutuzumab at Cycle 2 for a total of 6 cycles and refer to the obinutuzumab prescribing information for recommended dosing. Administer CALQUENCE CAPSULES prior to obinutuzumab when given on the same day. Advise patients to swallow capsule whole with water. Advise patients not to open, break or chew the capsules. CALQUENCE CAPSULES may be taken with or without food. If a dose of CALQUENCE CAPSULES is missed by more than 3 hours, it should be skipped and the next dose should be taken at its regularly scheduled time. Extra capsules of CALQUENCE CAPSULES should not be taken to make up for a missed dose. 5.2 Recommended Dosage for Hepatic Impairment Avoid administration of CALQUENCE CAPSULES in patients with severe hepatic impairment. Dose modifications are not required for patients with mild or moderate hepatic impairment [see Use in Specific Populations (11.6) and Clinical Pharmacology (13.3)]. 5.3 Recommended Dosage for Drug Interactions Dose Modifications for Use with CYP3A Inhibitors or Inducers These are described in Table 1 [see Drug Interactions (10)]. Table 1: Recommended Dose Modifications for Use with CYP3A Inhibitors or Inducers CYP3A Co-administered Drug Recommended CALQUENCE CAPSULES use Inhibition Strong CYP3A inhibitor Avoid concomitant use. If these inhibitors will be used short- term (such as anti-infectives for up to seven days), interrupt CALQUENCE CAPSULES. Moderate CYP3A inhibitor 100 mg once daily. Induction Strong CYP3A inducer Avoid concomitant use. If these inducers cannot be avoided, increase CALQUENCE CAPSULES dose to 200 mg approximately every 12 hours. Concomitant Use with Gastric Acid Reducing Agents Proton Pump Inhibitors: Avoid concomitant use [see Drug Interactions (10)]. H2-Receptor Antagonists: Take CALQUENCE CAPSULES 2 hours before taking a H2-receptor antagonist [see Drug Interactions (10)]. Antacids: Separate dosing by at least 2 hours [see Drug Interactions (10)]. 5.4 Dose Modifications for Adverse Reactions Recommended dose modifications of CALQUENCE CAPSULES for Grade 3 or greater adverse reactions are provided in Table 2. Table 2: Recommended Dose Modifications for Adverse Reactions Event Adverse Dose Modification Reaction (Starting dose = 100 mg approximately Occurrence every 12 hours) First and Interrupt CALQUENCE CAPSULES. Grade 3 or greater non- Second hematologic toxicities, Once toxicity has resolved to Grade 1 or baseline level, CALQUENCE CAPSULES Grade 3 thrombocytopenia may be resumed at 100 mg approximately with bleeding, every 12 hours. Third Interrupt CALQUENCE CAPSULES. Grade 4 thrombocytopenia or Once toxicity has resolved to Grade 1 or Grade 4 neutropenia lasting baseline level, CALQUENCE CAPSULES longer than 7 days may be resumed at a reduced frequency of 100 mg once daily. Fourth Discontinue CALQUENCE CAPSULES. Refer to the obinutuzumab prescribing information for management of obinutuzumab toxicities. 6. DOSAGE FORMS AND STRENGTHS 100 mg capsules.

פרטי מסגרת הכללה בסל
א. התרופה תינתן לטיפול במקרים האלה:1. התרופה תינתן לטיפול בלימפומה מסוג Mantle cell בעבור חולים שמחלתם חזרה (relapsed) לאחר טיפול קודם אחד לפחות. התרופה לא תינתן בשילוב עם Bortezomib.במהלך מחלתו החולה יהיה זכאי לטיפול בתרופה אחת בלבד ממשפחת מעכבי BTK.הטיפול בתרופה יינתן לחולה שטרם טופל במעכב BTK למחלתו.2. כמונותרפיה או בשילוב עם Obinutuzumab, לטיפול בלוקמיה מסוג CLL בחולה שטרם קיבל טיפול למחלתו או בחולה שמחלתו חזרה (relapsed) או הייתה עמידה (refractory) לטיפול קודם שכלל משטר טיפול מסוג BR או FCR או Obinutuzumab או Chlormabucil עם נוגדן anti CD20 או Venetoclax.לעניין עמידות לטיפול קודם - החולה לא יידרש להוכיח עמידות ליותר מאשר קו טיפול אחד, כמפורט לעיל. הישנות תוגדר כעליית לימפוציטים (הכפלה בשנה) ו/או הופעת קשרי לימפה חדשים או הגדלה ניכרת של הקיימים ו/או הגדלה ניכרת של הטחול או מעבר לשלב 3 או 4 של המחלה (אנמיה ו/או תרומבוציטופניה).במהלך מחלתו החולה יהיה זכאי לטיפול בתרופה אחת בלבד ממשפחת מעכבי BTK, למעט חולים אשר טופלו בשילוב של Ibrutinib יחד עם Venetoclax בטיפול קצוב בזמן בקו ראשון אשר יהיו זכאים לקו טיפול נוסף במעכב BTK כמונותרפיה.הטיפול בתרופה יינתן לחולה שטרם טופל במעכב BTK למחלתו, למעט חולים אשר טופלו בשילוב של Ibrutinib יחד עם Venetoclax בטיפול קצוב בזמן בקו ראשון אשר יהיו זכאים לקו טיפול נוסף במעכב BTK כמונותרפיה.התרופה לא תינתן בשילוב עם Venetoclax. ב. מתן התרופה האמורה ייעשה לפי מרשם של רופא מומחה באונקולוגיה או רופא מומחה בהמטולוגיה.
מסגרת הכללה בסל
התוויות הכלולות במסגרת הסל
| התוויה | תאריך הכללה | תחום קליני | Class Effect | מצב מחלה |
|---|---|---|---|---|
| בלוקמיה מסוג CLL בחולה שטרם קיבל טיפול למחלתו או בחולה שמחלתו חזרה (relapsed) או הייתה עמידה (refractory) לטיפול קודם | 01/03/2021 | אונקולוגיה | Chronic lymphocytic leukemia, CLL | |
| בלימפומה מסוג Mantle cell בעבור חולים שמחלתם חזרה (relapsed) לאחר טיפול קודם אחד לפחות | 01/03/2021 | אונקולוגיה | Mantle cell lymphoma, MCL | |
| כמונותרפיה או בשילוב עם Obinutuzumab, לטיפול בלוקמיה מסוג CLL בחולה שטרם קיבל טיפול למחלתו או בחולה שמחלתו חזרה (relapsed) או הייתה עמידה (refractory) לטיפול קודם שכלל משטר טיפול מסוג BR או FCR או Obinutuzumab או Chlormabucil עם נוגדן anti CD20 או Venetoclax. לעניין עמידות לטיפול קודם - החולה לא יידרש להוכיח עמידות ליותר מאשר קו טיפול אחד, כמפורט לעיל. הישנות תוגדר כעליית לימפוציטים (הכפלה בשנה) ו/או הופעת קשרי לימפה חדשים או הגדלה ניכרת של הקיימים ו/או הגדלה ניכרת של הטחול או מעבר לשלב 3 או 4 של המחלה (אנמיה ו/או תרומבוציטופניה) במהלך מחלתו החולה יהיה זכאי לטיפול בתרופה אחת בלבד ממשפחת מעכבי BTK. הטיפול בתרופה יינתן לחולה שטרם טופל במעכב BTK למחלתו. התרופה לא תינתן בשילוב עם Venetoclax. | 03/02/2022 | אונקולוגיה | Chronic lymphocytic leukemia, CLL | |
| כמונותרפיה או בשילוב עם Obinutuzumab, לטיפול בלוקמיה מסוג CLL בחולה שטרם קיבל טיפול למחלתו או בחולה שמחלתו חזרה (relapsed) או הייתה עמידה (refractory) לטיפול קודם שכלל משטר טיפול מסוג BR או FCR או Obinutuzumab או Chlormabucil עם נוגדן anti CD20 או Venetoclax. לעניין עמידות לטיפול קודם - החולה לא יידרש להוכיח עמידות ליותר מאשר קו טיפול אחד, כמפורט לעיל. הישנות תוגדר כעליית לימפוציטים (הכפלה בשנה) ו/או הופעת קשרי לימפה חדשים או הגדלה ניכרת של הקיימים ו/או הגדלה ניכרת של הטחול או מעבר לשלב 3 או 4 של המחלה (אנמיה ו/או תרומבוציטופניה). במהלך מחלתו החולה יהיה זכאי לטיפול בתרופה אחת בלבד ממשפחת מעכבי BTK, למעט חולים אשר טופלו בשילוב של Ibrutinib יחד עם Venetoclax בטיפול קצוב בזמן בקו ראשון אשר יהיו זכאים לקו טיפול נוסף במעכב BTK כמונותרפיה. הטיפול בתרופה יינתן לחולה שטרם טופל במעכב BTK למחלתו, למעט חולים אשר טופלו בשילוב של Ibrutinib יחד עם Venetoclax בטיפול קצוב בזמן בקו ראשון אשר יהיו זכאים לקו טיפול נוסף במעכב BTK כמונותרפיה. התרופה לא תינתן בשילוב עם Venetoclax. | 17/03/2024 | אונקולוגיה | Chronic lymphocytic leukemia, CLL |
שימוש לפי פנקס קופ''ח כללית 1994
לא צוין
תאריך הכללה מקורי בסל
01/03/2021
הגבלות
תרופה מוגבלת לרישום ע'י רופא מומחה או הגבלה אחרת
מידע נוסף
