Quest for the right Drug
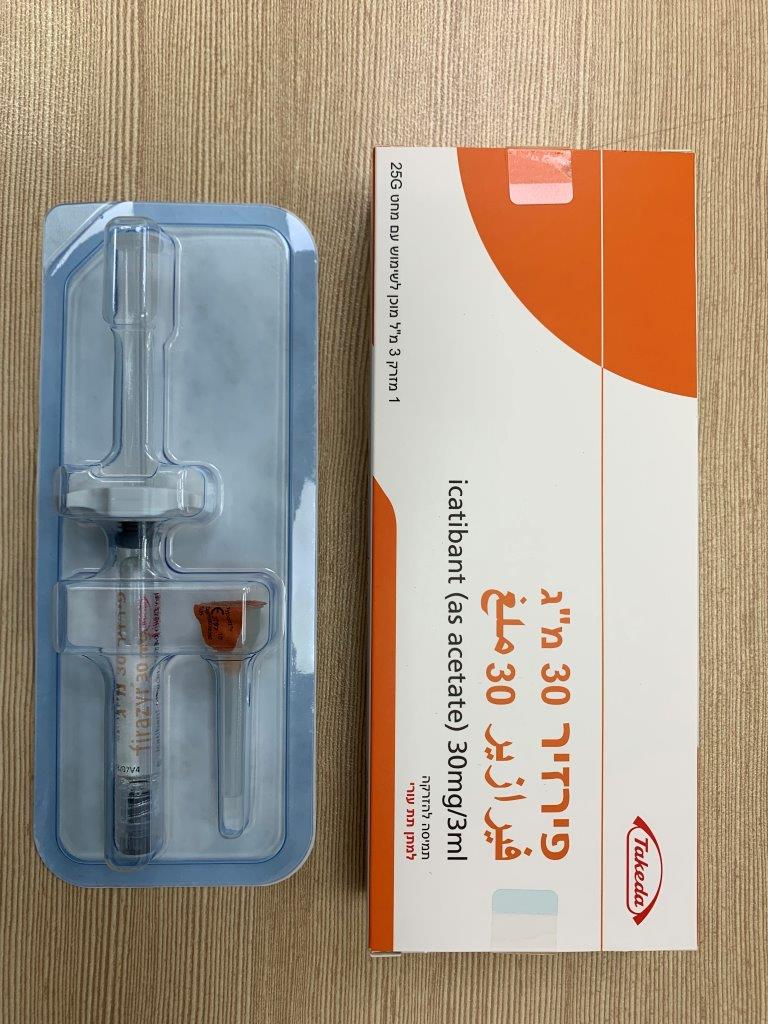
פירזיר 30 מ"ג FIRAZYR 30 MG (ICATIBANT AS ACETATE)
תרופה במרשם
תרופה בסל
נרקוטיקה
ציטוטוקסיקה
צורת מתן:
תת-עורי : S.C
צורת מינון:
תמיסה להזרקה : SOLUTION FOR INJECTION
עלון לרופא
מינוניםPosology התוויות
Indications תופעות לוואי
Adverse reactions התוויות נגד
Contraindications אינטראקציות
Interactions מינון יתר
Overdose הריון/הנקה
Pregnancy & Lactation אוכלוסיות מיוחדות
Special populations תכונות פרמקולוגיות
Pharmacological properties מידע רוקחי
Pharmaceutical particulars אזהרת שימוש
Special Warning עלון לרופא
Physicians Leaflet
Adverse reactions : תופעות לוואי
4.8 Undesirable effects Summary of the safety profile In clinical studies used for registration, a total of 999 HAE attacks have been treated with 30 mg Firazyr administered subcutaneously by a healthcare professional. Firazyr 30 mg SC has been administered by a healthcare professional to 129 healthy subjects and 236 patients with HAE. Almost all subjects who were treated with subcutaneous icatibant in clinical trials developed reactions at the site of injection (characterised by skin irritation, swelling, pain, itchiness, erythema, burning sensation). These reactions were generally mild to moderate in severity, transient, and resolved without further intervention. Tabulated list of adverse reactions The frequency of adverse reactions listed in Table 1 is defined using the following convention: Very common (≥1/10); common (≥1/100 to <1/10); uncommon (≥1/1,000 to <1/100); rare (≥1/10,000 to <1/1,000); very rare (<1/10,000). All adverse reactions from post-marketing experience are italicised. Table 2: Adverse reactions reported with icatibant System Organ Class Preferred Term (incidence category) Nervous system disorders (Common, ≥1/100 to <1/10) Dizziness Headache Gastrointestinal disorders (Common, ≥1/100 to <1/10) Nausea Skin and subcutaneous tissue disorders (Common, ≥1/100 to <1/10) Rash Erythema Pruritus (Unknown) Urticaria General disorders and administration site conditions (Very Common, ≥1/10) Injection site reactions* (Common, ≥1/100 to <1/10) Pyrexia Investigations (Common, ≥1/100 to <1/10) Transaminases increased * Injection site bruising, Injection site hematoma, Injection site burning, Injection site erythema, Injection site hypoesthesia, Injection site irritation, Injection site numbness, Injection site edema, Injection site pain, Injection site pressure sensation, Injection site pruritus, Injection site swelling, Injection site urticaria, and Injection site warmth. Paediatric Population A total of 32 paediatric patients (8 children aged 2 to 11 years and 24 adolescents aged 12 to 17 years) with HAE were exposed to treatment with icatibant during clinical studies. Thirty-one patients received a single dose of icatibant and 1 patient (an adolescent) received icatibant for two HAE attacks (in total, two doses). Firazyr was administered by subcutaneous injection at a dose of 0.4 mg/kg based on body weight to a maximum dose of 30 mg. The majority of paediatric patients who were treated with subcutaneous icatibant experienced injection site reactions such as erythema, swelling, burning sensation, skin pain and itching/pruritus; these were found to be mild to moderate in severity and consistent with reactions that have been reported in adults. Two paediatric patients experienced injection site reactions which were assessed as severe and which were completely resolved within 6 hours. These reactions were erythema, swelling, burning and warm sensation. No clinically significant changes in reproductive hormones were observed during clinical studies. Description of selected adverse reactions Immunogenicity Across repeated treatment in adults in the controlled phase III trials, transient positivity to anti-icatibant antibodies was observed in rare cases. All patients maintained efficacy. One Firazyr-treated patient tested positive for anti-icatibant antibodies before and after treatment with Firazyr. This patient was followed for 5 months and further samples were negative for anti-icatibant antibodies. No hypersensitivity or anaphylactic reactions were reported with Firazyr. Reporting of suspected adverse reactions Reporting suspected adverse reactions after authorisation of the medicinal product is important. It allows continued monitoring of the benefit/risk balance of the medicinal product. Any suspected adverse events should be reported to the Ministry of Health according to the National Regulation by using an online form https://sideeffects.health.gov.il/

פרטי מסגרת הכללה בסל
התרופה תינתן לטיפול סימפטומטי בהתקפים חריפים של אנגיואדמה תורשתית בחולים עם חסר ב-C1 esterase inhibitor בהתאם למפורט להלן: א. החולה מצוי בטיפול ומעקב של מרפאה לאימונולוגיה קלינית; ב. החולה סובל מהתקפים חוזרים של כאבי בטן חזקים או התקפים חוזרים של היצרות לרינקס; ג. הטיפול יינתן באישור מומחה באלרגיה ואימונולוגיה המטפל בחולה במסגרת מרפאה לאימונולוגיה קלינית. ד. לא יינתנו לחולה באותו התקף שתי התרופות – CONESTAT ALFA, ICATIBANT, C1 ESTERASE INHIBITOR, HUMAN.
מסגרת הכללה בסל
התוויות הכלולות במסגרת הסל
| התוויה | תאריך הכללה | תחום קליני | Class Effect | מצב מחלה |
|---|---|---|---|---|
| התרופה תינתן לטיפול סימפטומטי בהתקפים חריפים של אנגיואדמה תורשתית בחולים עם חסר ב-C1 esterase inhibitor |
שימוש לפי פנקס קופ''ח כללית 1994
לא צוין
תאריך הכללה מקורי בסל
03/01/2010
הגבלות
תרופה מוגבלת לרישום ע'י רופא מומחה או הגבלה אחרת
מידע נוסף
